Ciclo di Carnot
Un ciclo fondamentale per lo studio della termodinamica è il ciclo di Carnot, detto anche ciclo di massimo rendimento. Esso viene eseguito da una macchina termica ideale ed è costituito da due trasformazioni adiabatiche e da due trasformazioni isoterme.
Ipotizziamo di avere 1kg di gas nelle condizioni iniziali P1V1T1 contenuto in un cilindro in cui scorre uno stantuffo con possibilità di riscaldare, raffreddare e isolare adiabaticamente il gas.


L12 (area 122'1') :espansione isoterma, il lavoro è positivo
perchè il volume aumenta
L23 (area 233'2') :espansione adiabatica, il lavoro è positivo
perchè il volume aumenta
L34 (area 344'3') :compressione isoterma, il lavoro è negativo
perchè il volume diminuisce
L41 (area 411'4') :compressione adiabatica, il lavoro è negativo
perchè il volume diminuisce.
Si deduce che il lavoro complessivo espresso dal ciclo è positivo.
Osservando poi il diagramma entropico e tenendo conto che ΔQ=T·ΔS
si ricava
Q12 (area 122'1') :espansione isoterma, il calore scambiato
è positivo perchè l'entropia aumenta
Q23 (area nulla) :espansione adiabatica, i processi adiabatici
prevedono ΔQ=0.
Q34 (area 341'2') :compressione isoterma, il calore scambiato
è negativo perchè l'entropia diminuisce.
Q41 (area nulla) :compressione adiabatica, come tale ΔQ=0.
Indicando con Qs il calore scambiato con la sorgente termica alla temperatura superiore e con Qi quello scambiato con la sorgente a temperatura inferiore si ha
![]()
per definizione il rendimento è 
ma osservando il disegno 

Alle stesse conclusioni si arriva osservando le trasformazioni sul piano
PV.
Il ciclo di Carnot è un ciclo simmetrico; i cicli simmetrici sono costituiti
da trasformazioni a due a due uguali in modo da poter chiudere il percorso.
Una rappresentazione del processo e riportato in questa pagina.
Per un ciclo simmetrico è possibile dimostrare che è


Ricordiamo che per una trasformazione isoterma è

Ricordiamo che durante una trasformazione isoterma ΔU=0 non vi è variazione di energia interna del sistema, quindi il primo principio della termodinamica diventa Q=L

Qs>0 perché V2>V1.
poi avremo  ma
a noi serve il modulo di |Qi| →
ma
a noi serve il modulo di |Qi| → 
sapendo che per i cicli simmetrici valgono le relazioni  dunque
dunque
 sostituendo
nella formula del rendimento
sostituendo
nella formula del rendimento

T1=Ts temperatura della sorgente superiore di calore
T3=Ti temperatura della sorgente inferiore di calore
v1 [m3/kg]
v2 [m3/kg]
v3 [m3/kg]
pmax [kPa]
Ciclo Stirling
Il ciclo Stirling (1816) è costituito da quattro trasformazioni reversibili, rappresentate nel disegno


A.) trasformazione 12, espansione isoterma alla temperatura T1
B.) trasformazione 23, trasformazione isocora da T2 a T3
C.) trasformazione 34, compressione isoterma alla temperatura T3
D.) trasformazione 41, isocora da T4=T3 a T1.
come nel caso del ciclo di Carnot
 mentre
mentre 
qui proprio perché è evidente dal disegno che V3=V2 e V4=V1.
per quanto riguarda le isocore, trattandosi di trasformazioni a volume costante, bisogna usare il calore specifico appropriato (a volume costante).
![]() quindi
quindi

nell'isocora 23 il gas cede una certa quantità di calore che viene riassorbita in ugual misura nella trasformazione 41.
Come nel caso del ciclo precedente si avrà 
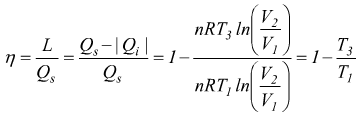
viene ottenuta una formula per il rendimento identica al ciclo di Carnot

La macchina di Stirling ebbe una certa diffusione per diversi anni, ma in seguito all'avvento delle macchine a vapore e a quelle a combustione interna, cadde in disuso.
Argomenti correlati:
 edutecnica
edutecnica