Macchine termiche
Per macchina termica si intende una macchina che sia in grado di trasformare
il calore in lavoro.
L'operazione inversa, cioè trasformare lavoro in calore
è molto semplice:
se si sfregano insieme due pietre, il lavoro compiuto per vincere gli attriti
si trasforma in energia interna che tende ad aumentare la temperatura delle
pietre stesse; non appena la temperatura delle pietre diventa superiore
a quella dell’ambiente si verifica un passaggio di calore dalle pietre all’ambiente,
aumentando la temperatura di quest’ultimo.
Se però, quest’ultimo è sufficientemente ampio (serbatoio ideale di calore)
esso potrà non subire nessuna sensibile variazione di temperatura pur mantenendosi
in equilibrio termico con le pietre. In questo caso si avrà una trasformazione
di lavoro in calore che
- non altera lo stato del sistema (le pietre)
- ha un'efficienza del 100%
- può essere fatta proseguire all'infinito
Per studiare il processo inverso, cioè la conversione di calore in lavoro, dobbiamo procurarci una trasformazione, o una serie di trasformazioni, per mezzo delle quali si possa realizzare indefinitivamente tale conversione senza che questa implichi una variazione dello stato del sistema. A prima vista, l'espansione isoterma di un gas ideale sembrerebbe idonea per trasformare calore in lavoro. In tal caso, infatti, non vi è variazione di energia interna ΔU dal momento che la temperatura rimane costante quindi per il primo principio della termodinamica Q=L ; cioè del calore è stato completamente trasformato in lavoro.
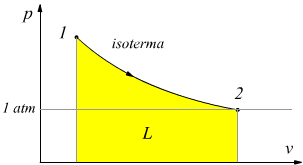
Questa trasformazione, tuttavia, implica un cambiamento di stato del gas.
Il volume aumenta e la pressione diminuisce, fino a che non raggiunge il
valore atmosferico, e a questo punto la trasformazione cessa; quindi essa
non può proseguire all'infinito.
Quello che a noi serve è una serie di trasformazioni che riportino il sistema
allo stato iniziale, cioè un ciclo termodinamico.
Lo scopo di una macchina termica è quello di fornire continuamente lavoro
all'esterno percorrendo più volte lo stesso ciclo.
Il lavoro netto del ciclo rappresenta ciò che esce dal sistema ed il calore
dalla sostanza che lavora è ciò che entra. L'efficienza termica o il rendimento
viene così definito:
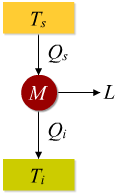
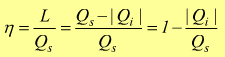
M = macchina termica
L = lavoro prodotto
Qs =calore assorbito dalla sorgente alla temperatura superiore
Ts(più calda)
Qi =calore ceduto alla sorgente di temperatura inferiore Ti
(più fredda)
Infatti applicando il primo principio ad Q=L+ΔU, ad un ciclo completo
e ricordando che non c'è variazione di energia interna perchè U=U(T) cioè
l'energia interna dipende solo dalla temperatura e per un ciclo chiuso
Tf = Ti → Uf = Ui → ΔU=0
(se temperatura
iniziale e temperatura finale coincidono allora devono coincidere anche
l'energia interna dello stato finale con quella dello stato iniziale) Q=L
→ Qs-|Qi|=L .
Qi deve essere preso in valore assoluto, perché dal punto di vista del sistema è negativo, visto che si tratta di calore ceduto.
La trasformazione di calore in lavoro si ottiene in pratica per mezzo di due tipi di dispositivi:
- i motori a combustione interna (motore a benzina, motore Diesel);
- i motori a combustione esterna (macchina di Stirling e la macchina a vapore).
In entrambi i casi, un gas o una miscela di gas contenuti in un cilindro,
eseguono un , ciclo, costringendo un pistone ad impartire un moto rotazionale
ad un albero. E' necessario in tutti e due i dispositivi, che ad un certo
punto del ciclo, la temperatura e la pressione del gas aumentino.
Nella macchina a vapore (ved. ciclo Rankine) e nella macchina di Stirling
questo si ottiene per mezzo di una caldaia esterna.
Nei motori a combustione interna, invece, l'elevata temperatura e l'alta
pressione si ottengono per mezzo di una reazione chimica tra combustibile
ed aria; reazione che ha luogo nel ciclindro stesso.
Nel motore a benzina,
la combustione della miscela benzina+aria ha luogo in maniera esplosiva
attraverso l'intervento di una scintilla elettrica.
Il motore Diesel,
invece, usa il gasolio come combustibile e la combustione ha luogo più lentamente,
spuzzando il gasolio in dosi opportune nel cilindro surriscaldato.
Cicli termodinamici
Un ciclo termodinamico è costituito da una serie di trasformazioni successive
che riportano il fluido sempre al suo stato fisico iniziale.
Bisogna, ovviamente, tener conto delle convenzioni di segno per il lavoro
ed il calore scambiato dal fluido di lavoro (sistema)
durante una trasformazione:
Q > 0 quando il calore viene trasferito dall'ambiente
al sistema : il sistema riceve calore
Q < 0 quando il calore viene trasferito dal sistema all'ambiente : il sistema
cede calore
L > 0 quando il lavoro viene fatto dal sistema sull'ambiente (espansione)
L < 0 quando il lavoro viene fatto dall'ambiente sul sistema (compressione).
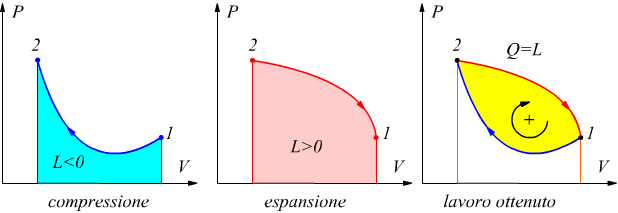
Si è visto come un gas a pressione costante possa produrre lavoro semplicemente espandendosi
L=P·ΔV
Il lavoro prodotto può essere interpretato graficamente come l'area sottesa alla curva che descrive la trasformazione sul piano PV.
Nel disegno è descritto un ciclo termodinamico sul piano costituito da
due trasformazioni.
La trasformazione 1 → 2 è una compressione e quindi il lavoro dato
dall'area sottesa alla curva è negativo (L12<0).
La trasformazione 2 → 1 è una espansione dunque il lavoro rappresentato
dall'area sottostante è positivo (L21>0).
Il lavoro del ciclo è pari alla la somma algebrica
dei lavori compiuti nelle singole trasformazioni.
N.B.:il lavoro non è una funzione di stato il suo valore dipende
dall'area sottostante la curva, quindi dipende da quest'ultima, non dai
valori iniziali e finali assunti sul piano termodinamico.
In questo caso, si deduce che il lavoro complessivamente espresso dal ciclo è positivo.
Per convenzione, il lavoro di un ciclo termodinamico è positivo se il ciclo è percorso in senso orario (macchine motrici: turbine) mentre è negativo se il ciclo è percorso in senso antiorario (macchine operatrici: pompe, compressori) .
Per il primo principio della termodinamica Q=L+ΔU ma sappiamo che
l'energia interna U è una funzione di stato, cioè essa dipende soltanto
dalla differenza tra lo stato finale e quello iniziale.
In una successione ciclica di trasformazioni come quella vista, si ha Uf=Ui
: lo stato iniziale e finale coincidono quindi ΔU=0 e L=Q.
Cioè il lavoro prodotto per effettuare il ciclo è pari alla somma algebrica
del calore scambiato lungo le singole trasformazioni.
Per proseguire nello studio dei cicli termodinamici è consigliabile tenere presente le annotazioni fatte fin qui, sulla pagina dei gas, in particolare, quanto detto sulle trasformazioni.
Argomenti correlati:
 edutecnica
edutecnica