Acqua
L'acqua è il costituente principale di tutti gli organismi viventi uomo compreso, infatti, più del 70% del nostro corpo è composto da acqua. Circa i 7/10 della superficie terrestre sono ricoperti da acque dolci e salate, allo stato solido o liquido.
In questa pagina vengono considerate le peculiarità principali di questa importante sostanza.
Caratteristiche chimiche dell’acqua
L'acqua è il composto più importante dell'idrogeno e dell'ossigeno e le sue proprietà fisiche e chimiche ne fanno una sostanza dalle caratteristiche uniche. La sua molecola è costituita da due atomi di idrogeno e uno di ossigeno tenuti insieme da legami covalenti polari formanti un angolo di circa 105°.
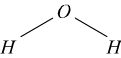
Questa geometria conferisce polarità alle molecole. A causa di tale polarità le molecole dell'acqua tendono ad associarsi in gruppi di molecole tra le quali si instaurano veri e propri legami: legami a idrogeno.
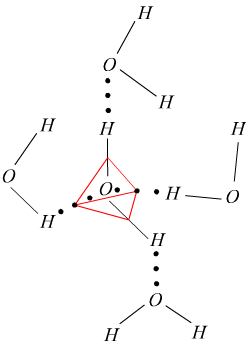
La forza di questi legami dipende dallo stato fisico dell'acqua.
Proprietà dell'acqua
Chimicamente l'acqua è un composto molto stabile, a temperature superiori ai 2000 °C la sua decomposizione negli elementi costituenti non supera il 2%. Tale stabilità è, ovviamente, dovuta ai forti legami covalenti tra gli atomi di ossigeno e di idrogeno. L'acqua reagisce con i metalli alcalini (metalli del 1° gruppo):
![]()
Reagisce poi, con gli ossidi ionici dei metalli più reattivi l'acqua, fornendo i rispettivi idrossidi:
![]()
mentre con gli ossidi dei non metalli (anidridi) forma gli ossiacidi:
![]()
L'acqua, inoltre, è caratterizzata da un elevato potere solvente collegato
alla polarità delle sue molecole.
In conformità alla regola empirica "il simile scioglie il suo simile", essa
è in grado di sciogliere le sostanze dotate di legami ionici, o parzialmente
ionici, nonché tutte quelle sostanze in grado di formare con essa legami
a idrogeno come, ad esempio, ammoniaca, alcol etilico, carboidrati ecc.
L'acqua è in grado anche di sciogliere quantità più o meno piccole di molecole
gassose come la CO2 e l'02.
La possibilità che ha l'acqua di sciogliere l'ossigeno è, in particolare,
importante per gli animali acquatici che usano speciali membrane situate
nelle branchie, per assumere l'ossigeno disciolto indispensabile alla loro
respirazione.
Cambiamenti di stato dell'acqua
Come mostra il disegno seguente, l'acqua può presentarsi in tre stati: solido (ghiaccio), liquido (acqua) e gassoso (vapore acqueo).
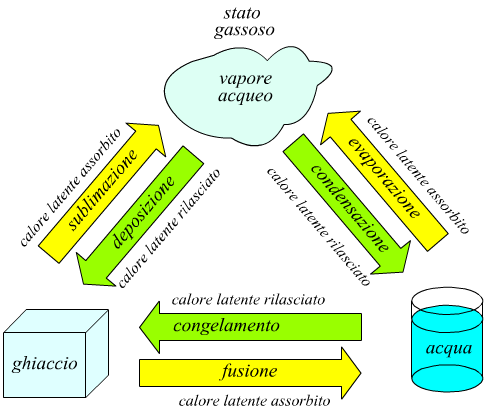
Un cambiamento di stato da solido a liquido, da liquido a gas e da solido
a gas richiede energia sotto forma di calore. Il calore latente è energia
che è stata sottratta all'ambiente circostante.
Quando il cambiamento di stato avviene in senso contrario cioè da liquido
a solido, da gas a liquido o da gas a solido, questo calore latente viene
rilasciato nell'ambiente circostante.
Per ogni tipo di transizione vi è un nome specifico indicato in figura.
fusione, congelamento, evaporazione e condensazione sono tutti termini familiari.
Il termine sublimazione indica il passaggio diretto da solido a vapore.
Si può notare che i cubetti di ghiaccio del congelatore, dopo un certo tempo
rimpiccioliscono e si staccano dalle pareti della vaschetta: la diminuzione
di volume è dovuta alla sublimazione indotta dalla circolazione di aria
fredda e secca nel freezer. I cubetti di ghiaccio perdono massa direttamente
sotto forma di vapore senza fondere.
La deposizione è il processo inverso, quando il vapore acqueo cristallizza
direttamente sotto forma di ghiaccio. Spesso viene detto sublimazione anche
il passaggio da gas a solido. In questa pagina, per evitare confusioni,
lo chiameremo deposizione. La brina, che si forma in una fredda notte d'inverno,
ne è un esempio.
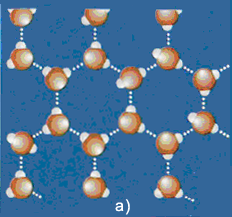
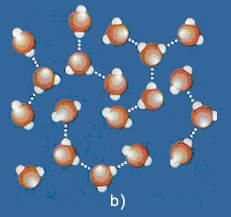
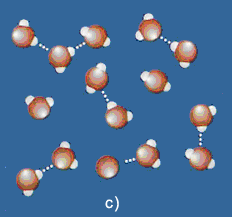
Riepilogando, l'acqua può dunque effettuare tre passaggi di stato: dal ghiaccio (a), nel quale le molecole sono geometricamente disposte, si passa, con l'aumentare della temperatura, all'acqua (b) in cui si rompono molti legami a idrogeno, e poi al vapore (c) in cui i legami a idrogeno sono ridotti al minimo.
Acqua come sostanza di riferimento
Dal momento che è molto facile ottenere acqua di elevata purezza, essa
viene impiegata come sostanza di riferimento per definire alcune grandezze
chimico-fisiche:
● la densità, che è una grandezza derivata,
si riferisce alla massa di 1 ml di acqua che a 4 °C misura 1 g;
● le scale termometriche, sono tutte riferite
alle temperature di congelamento e di ebollizione dell'acqua che, come si
sa, sono rispettivamente 0 °C e 100 °C nella scala Celsius;
● la caloria, che, come si ricorderà, è la
quantità di calore necessaria a innalzare di 1 °C (da 14,5 a 15,5 °C) un
grammo di acqua;
● il pH, che rappresenta il grado di acidità
di una sostanza e fa, anch'esso, riferimento all'acqua pura alla quale viene
assegnato il valore 7 che indica la neutralità.
Ciclo dell'acqua
L'acqua gioca diversi ruoli chiave nel nostro pianeta. Prima di tutto, una grande quantità di acqua si trova negli oceani, che coprono più dei due terzi della superficie terrestre e agiscono come riserva di calore che ridistribuiscono dalle basse alle alte latitudini mediante le correnti oceaniche. Funzionano anche come riserve di sostanze disciolte che vanno dai sali agli elementi nutritivi. In secondo luogo, l'acqua cade sulla Terra sotto forma di pioggia o neve. Quando scorre verso il mare, erode i suoli creando varietà di paesaggi. L'acqua, fluendo, trasporta elementi nutritivi da un luogo all'altro e influenza così la distribuzione della vita animale e vegetale. Infine l'acqua nell'aria sposta grandi quantità di calore: assorbe calore superficiale, durante l'evaporazione, specialmente sopra gli oceani caldi, e rilascia calore latente con la condensazione o la deposizione sopra le regioni più fredde. Analogamente al flusso di calore nelle correnti oceaniche, questo movimento è generalmente diretto verso i poli.
L'idrosfera comprende l'acqua esistente sulla Terra in tutte le sue forme. Circa il 97,2% dell'idrosfera è costituito dall'acqua salata degli oceani come ci mostra il disegno seguente.

Il rimanente 2,8% è acqua dolce, di cui la più ampia riserva è immagazzinata sotto forma di ghiaccio nelle calotte glaciali e nei ghiacciai montani e rappresenta il 2,15% del totale. L'acqua dolce liquida sulle terre emerse è una parte molto piccola (lo 0,65%) della riserva totale d'acqua. della Terra.
L'acqua dolce allo stato liquido si trova sia al di sopra che al di sotto della superficie terrestre. L'acqua presente nelle cavità del suolo e delle rocce è detta acqua sotterranea. La maggior parte viene immagazzinata in un serbatoio profondo detto falda idrica, a un livello che le radici delle piante non possono raggiungere. L'acqua della falda costituisce lo 0,63% dell'idrosfera e ne resta quindi solo lo 0,02%.
Si deduce che quasi tutte le acque della Terra sono contenute negli oceani. Gli specchi d'acqua dolce e le acque del suolo costituiscono solo una piccola frazione del volume totale delle acque del globo.
La parte destra del disegno precedente, mostra come viene ripartita questa piccola porzione rimanente dell'acqua, che è però molto importante per la vita sulla Terra perché comprende l'acqua disponibile per le piante, gli animali e l'uomo. L'umidità nel suolo, che è contenuta nel terreno alla portata delle radici delle piante, comprende lo 0,005% del totale generale. L'acqua contenuta in corsi d'acqua, laghi, paludi e acquitrini è detta acqua superficiale: la maggior parte è quasi equamente suddivisa tra laghi salati e laghi d'acqua dolce. Una porzione estremamente piccola è contenuta nei corsi d'acqua e nei fiumi che scorrono verso i mari o verso i laghi interni. Il ciclo dell'acqua descrive il flusso globale dell'acqua dall'uno all'altro dei grandi serbatoi di riserva. Il ciclo dell'acqua descrive il flusso globale dell'acqua dall'uno all'altro dei grandi serbatoi di riserva.
Si nota anche che la quantità d'acqua contenuta nell'atmosfera sotto forma di vapore e di goccioline nelle nuvole è molto piccola: lo 0,001% dell'idrosfera. Sebbene piccola, questa riserva d'acqua è di enorme importanza perché rifornisce con le precipitazioni i serbatoi d'acqua dolce delle terre emerse. E, come vedremo nel prossimo capitolo, il flusso di vapore acqueo dai caldi oceani tropicali alle regioni più fredde fornisce un flusso globale di calore latente dalle basse alle alte latitudini.
I movimenti di acqua tra le grandi riserve mondiali, costituiscono il ciclo dell'acqua qui sotto illustrato.
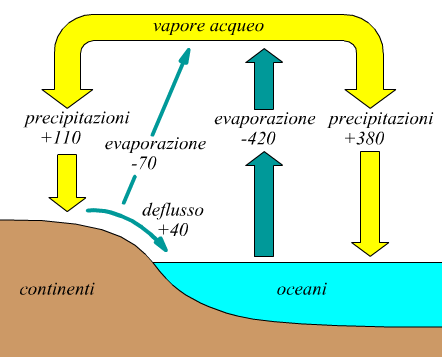
Il ciclo inizia con l'evaporazione dalle distese di acqua o dalla superficie terrestre: l'acqua cambia di stato da liquido a vapore e penetra nell'atmosfera. L'evaporazione totale è circa sei volte più grande sopra gli oceani rispetto alla terraferma perché gli oceani coprono la maggior parte del pianeta e perché le superfici terrestri non sono sempre abbastanza umide da fornire acqua per l'evaporazione. Una volta nell'atmosfera, il vapore acqueo può condensare o depositarsi per formare le precipitazioni che cadono sulla Terra sotto forma di pioggia o neve. Le precipitazioni sopra gli oceani sono quasi quattro volte maggiori di quelle sopra la terraferma. Le precipitazioni, quando raggiungono la superficie terrestre, possono avere tre destini diversi: l'acqua può evaporare e ritornare all'atmosfera; oppure, può penetrare nel suolo fino agli strati rocciosi sottostanti; oppure ancora le precipitazioni possono scorrere sulla terraferma raccogliendosi in fiumi e corsi d'acqua che alla fine defluiscono in mare o in un bacino interno. Questo ultimo tipo di movimento dell'acqua è conosciuto come deflusso.
Nel bilancio globale dell'acqua, schematizzato nel disegno precedente. Ci sono tre flussi da e per l'oceano: evaporazio ne (uscita), precipitazioni (entrata) e deflusso (entrata). Dal momento che "entrata" e "uscita" sono bilanciate si ha:
Precipitazione + Deflusso = Evaporazione (oceano)
Usando i valori del disegno, che sono espressi in migliaia di kilometri cubi, si ha:
380+40=420
Anche sui continenti ci sono tre flussi: precipitazioni (entrata), evaporazione (uscita) e deflusso (uscita). Quindi:
Precipitazione = Deflusso + Evaporazione (continenti)
Usando i valori in figura risulta:
110=70+40
Se si spostano i termini di quest'ultima equazione mettendo l'evaporazione prima, si ha:
Evaporazione = Precipitazione - Deflusso (continenti)
che può essere messa a sistema con:
Evaporazione = Precipitazione + Deflusso (oceano)
Prendendo la terraferma e gli oceani insieme e considerando solo il flusso d'acqua dalla superficie del pianeta all'atmosfera e viceversa, possiamo concludere che i termini del deflusso, all'interno delle due equazioni, si cancellano a vicenda. Quindi rimane l'evaporazione equivalente alla precipitazione (i valori numerici sono espressi in migliaia di kilometri cubi):
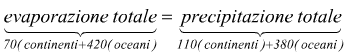
Il bilancio globale dell'acqua descrive i flussi di acqua tra oceano, atmosfera e terre emerse.
Classificazione delle acque
Dal punto di vista della provenienza le acque si distinguono in:
● acque profonde;
● acque sorgive;
● acque fluviali;
● acque lacustri;
● acque marine.
Dal punto di vista delle utilizzazioni si distinguono in:
● acque minerali;
● acque potabili;
● acque industriali;
● acque agricole.
Della prima classificazione se ne occupano principalmente i geologi e i
naturalisti, mentre della seconda i chimici.
Acque minerali
Col termine acque minerali vengono classificate quelle acque natura- li, di fonte o sorgente, che contengono disciolti meno di 0,1 g/l di sali e che possono anche contenere disciolti gas come CO2 e H2S. In base al contenuto possono ulteriormente essere classificate in acque da bibite e in acque da bagno le cui caratteristiche vengono riportate nella tabella seguente.
| Classificazione delle acque minerali | |
| acque da bibita | acque oligominerali (residuo salino a 180
°C minore di 0,20%) acque mediominerali (residuo salino a 180 °C compreso tra lo 0,20 e l'1%) acque minerali (residuo salino a 180 °C superiore all'1%): salse, sulfuree, arsenicali, ferruginose, bicarbonate, solfate |
| acque da bagno | acque fredde: salse, sulfuree,
bicarbonate (t<20 °C) acque ipotermali: salse, sulfuree, bicarbonate (t=20-30 °C) acque termali: salse, sulfuree, solfate (t=30-40 °C) acque termali: salse, sulfuree, bicarbonate, solfate (t>40 °C) |
Comunemente il contenuto salino di un'acqua è espresso in termini di durezza, intendendo per durezza di un'acqua la quantità di sali di Ca e Mg in essa contenuta.
Durezza delle acque
Particolare interesse assume la conoscenza della "durezza" dell'acqua che
è conferita soprattutto dai sali di calcio e magnesio (sotto forma di cloruri,
solfati e bicarbonati). Si fa distinzione tra diversi tipi di durezza:
1 durezza temporanea, dovuta ai bicarbonati
di calcio e di magnesio che in seguito a prolungata ebollizione danno luogo
a composti insolubili come i carbonati di calcio e di magnesio;
2 durezza permanente, dovuta ai cloruri e ai
solfati di calcio e di magnesio;
3 durezza totale, data dalla somma delle due
precedenti. La durezza dell'acqua viene espressa in diversi tipi di grado
secondo la seguente tabella:
| Tipo di grado | 1 grado di durezza significa | Fattori di conversione fra i vari tipi di grado | ||
| francese | 1 g di CaCO3 per 100 l di acqua | 1 | 0,56 | 0,70 |
| tedesco | 1 g di CaCO3 per 100 l di acqua | 1,79 | 1 | 1,25 |
| inglese | 1 g di CaCO3 per 70 l di acqua | 1,43 | 0,80 | 1 |
In genere in Italia sono adottati i gradi francesi. Un grado francese (1°f) di durezza corrisponde a 10 mg/l di CaCO3.
Acque potabili
Un'acqua per essere definita potabile deve essere:
limpida, incolore e inodore, aerata e di gusto gradevole, deve avere un determinato contenuto salino, deve essere priva di sstanze tossiche e non deve contenere batteri o virus che possano procurare gravi malattie infettive.
Per la legge italiana il controllo delle acque potabili deve essere effettuato dai laboratori provinciali di igiene e profilassi. Nella tabella seguente riportiamo i valori massimi consentiti per alcune sostanze contenute generalmente nell'acqua. Un'acqua non potabile può essere resa tale sottoponendola ad alcuni particolari trattamenti fisici o chimici tra cui ricordiamo:
● filtrazione: serve per chiarificare le
acque torbide mediante l'uso di filtri particolari di ghiaia e sabbia;
● sterilizzazione con radiazioni: serve per
rendere sterili le acque me diante l'uso di raggi ultravioletti, o raggi
X, o γ
● addolcimento: serve per diminuire il grado
di durezza di acque molto dure;
● sterilizzazione con reagenti chimici: l'uso
di reagenti chimici come cloruro di calce, cloro gassoso o di ipocloriti
rende le acque sterili per l'effetto batteriostatico del cloro.
Tali sostanze però hanno il difetto di alterare il sapore e l'odore dell'acqua
rendendolo sgradevole.
| Soluti dell'acqua oggetto d'analisi per stabilirne la potabilità | |
| Sostanze | Valori max. consentiti |
| CaO | 120 mg/l (p.p.m.) |
| MgO | 40 mg/l (p.p.m.) |
| residuo fisso a 180 °C | 300-500 mg/l (p.p.m.) |
| sostanze organiche (Kubel) | 2,5 mg/l (p.p.m.) |
| solfati espressi in SO3 | 100 mg/l (p.p.m.) |
| nitrati espressi in N2O5 | 27 mg/l (p.p.m.) |
| cloruri espressi in Cl | 35 mg/l (p.p.m.) |
| durezza totale | 32 gradi francesi |
| ammoniaca | assente |
| nitriti | assenti |
| fosfati | tracce |
Acque industriali
Nell'industria l'acqua interviene in numerosi processi:
● per alimentare le caldaie di quegli impianti
industriali che utilizzano il vapore;
● per il raffreddamento di alcuni impianti
che lavorano a elevate temperature;
● per alimentare quei processi industriali
dove l'acqua rappresenta una vera e propria materia prima.
Pertanto, le acque impiegate nei vari processi industriali debbono possedere requisiti che possono differire da industria a industria: le lavanderie richiedono acqua con minima durezza, mentre l'acqua per le industrie tessili deve risultare assolutamente priva di ferro, manganese e sostanze organiche; l'acqua per le cartiere non deve conte- nere né ferro né manganese o calcio e deve essere esente da ogni flora batterica; per gli zuccherifici si richiede acqua priva di solfati, cabonati e nitrati e così via. L'acqua destinata ad alimentare caldaie a vapore deve essere priva di sali incrostanti e corrosivi, pertanto deve possedere una durezza molto piccola o nulla. Il calcare, infatti, è il principale e più pericoloso responsabile delle incrostazioni anche dei più comuni elettrodomestici (scaldabagno, ferro a vapore ecc.).
Acque per uso agricolo
In agricoltura l'acqua esercita un ruolo vitale; non è possibile, infatti, alcuno sfruttamento del suolo senza un adeguato e razionale sistema di irrigazione. Per tale uso l'acqua non deve contenere elevate concentrazioni di quelle sostanze che risultano nocive alle colture come lo ione Na+ e lo ione Cl- che provocherebbero profonde alterazioni del terreno. Anche per l'allevamento del bestiame è richiesta acqua di elevata purezza con requisiti del tutto simili a quelli richiesti per l'acqua potabile.
 edutecnica
edutecnica