Proprietà delle soluzioni diluite
Come i gas, le soluzioni diluite possono essere descritte attraverso un certo numero di leggi, e sono dotate di alcune proprietà ( note anche come proprietà colligative ) che dipendono solo dalla concentrazione e non dalla natura dei componenti.
Se la concentrazione è sufficientemente bassa tutte le soluzioni hanno un comportamento descritto da queste leggi.
Pressione osmotica
Quando due soluzioni a diversa concentrazione, sono separate da una membrana porosa (semipermeabile) le molecole di solvente si spostano dalla soluzione a maggior concentrazione verso quella a minor concentrazione.
La pressione che deve essere applicata alla soluzione affinché questo transito non avvenga è chiamata pressione osmotica.
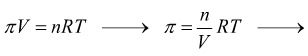
![]() con
con
R=costante universale dei gas
M=molarità della soluzione
T=temperatura in °K
Tensione di vapore delle soluzioni
La tensione di vapore delle soluzioni costituite da sostanze non volatili in un solvente è sempre minore di quella del solvente puro.
La riduzione della tensione di vapore , si spiega con l'interazione fra le molecole del soluto e del solvente sulla superficie del liquido che impedisce in parte alle molecole di solvente di passare allo stato di vapore.
Ad esempio, la temperatura di ebollizione di un liquido, è la temperatura alla quale la tensione di vapore del liquido, uguaglia la pressione esterna : essa può, dunque, essere modificata dall'aggiunta di un soluto non volatile che abbassa la tensione di vapore del solvente.
Questa proprietà viene descritta dalla legge di Raoult nella quale ci si riferisce ad una soluzione ideale di due liquidi a e b contenuti in un recipiente alla temperatura t :
![]()
p =tensione di vapore della soluzione
pa=tensione di vapore del componente a
pb=tensione di vapore del componente b
Raoult ha dimostrato che per una soluzione ideale di due ( o più liquidi
) a e b ad una data temperatura t, la pressione di vapore dovuta a ciascuno
di essi (pressione parziale) è data dalla pressione di vapore del liquido
puro ![]() a
quella stessa temperatura t per il valore della sua frazione molare
a
quella stessa temperatura t per il valore della sua frazione molare ![]() .
.
![]()
se il soluto b è un solido si ha ![]()
ovviamente per n componenti 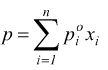
Si può anche esprimere la legge di Raoult attraverso l'abbassamento relativo della tensione di vapore
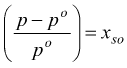
Innalzamento ebulloscopico
La differenza tra la temperatura di ebollizione della soluzione e quella del solvente puro è chiamata innalzamento ebulloscopico ΔTe , è proporzionale alla concentrazione molale della soluzione e ad una costante, riferita al solvente, chiamata costante ebulloscopica .
![]()
La costante ebulloscopica dell'acqua è 0,513 kg°C/mol.
Abbassamento crioscopico
Sempre a causa della riduzione della tensione di vapore , oltre ad un
innalzamento ebulloscopico si ha un abbassamento crioscopico ΔTc,
cioè un abbassamento del punto di congelamento.
L'abbassamento crioscopico è proporzionale alla concentrazione molale
della soluzione e ad una costante, riferita
al solvente, chiamata costante crioscopica.
![]()
La costante crioscopica dell'acqua è 1,86 kg°C/mol.
| Valori tipici della costante ebulloscopica e crioscopica | |||||
| Solvente | Te | Ke | Tf | Kc | |
| Acido acetico | 118.1°C | 3.07 | 16.6°C | 3.9 | |
| Acetone | 56.5°C | 1.71 | - 95°C | ---- | |
| Acido stearico | 383°C | ---- | 69.4°C | 4.5 | |
| Acqua | 100.0°C | 0.51 | 0.0°C | 1.86 | |
| Benzene | 80.15°C | 2.53 | 5.5°C | 4.9 | |
| Canfora | 208.3°C | 5.95 | 178.4°C | 37.7 | |
| Carbonio disolfuro | 46.3°C | 2.34 | - 108.6°C | ---- | |
| Carbonio tetracloruro | 76.8°C | 5.03 | - 22.8°C | ---- | |
| Cloroformio | 61.3°C | 3.63 | - 63.5°C | ---- | |
| Etanolo (alcool etilico) | 78.5°C | 1.22 | - 115°C | ---- | |
| Etere etilico | 34.6°C | 2.02 | - 120°C | ---- | |
| Fenolo | 182°C | 3.56 | 41°C | 7.4 | |
| Metanolo (alcool metilico) | 64.65°C | 0.83 | -97.8°C | ---- | |
| Nitrobenzene | 210.9°C | 5.24 | 5.7°C | 7.0 | |
| Toluene | 110.6°C | 3.33 | - 95°C | ---- | |
Dalle relazioni scritte in precedenza, risulta che l'innalzamento ebulloscopico, l'abbassamento crioscopico, la pressione osmotica e l'abbassamento relativo della tensione di vapore sono proporzionali alla molalità della soluzione e sono valide solo per soluti non dissociati, oltre che non volatili.
Nel caso il soluto sia costituito da composti ionici. queste relazioni devono essere opportunamente riviste; questo avviene perché queste sostanze, all'atto della dissoluzione in un solvente, si dissociano in frammenti o si associano in unità a più alta massa.
Indicando con α il grado di dissociazione , con ν il numero di ioni derivati da una singola molecola e con no il numero di moli presenti, prima della dissociazione, si ha che:
![]() numero
di moli dissoluto indissociato
numero
di moli dissoluto indissociato
![]() numero
di moli dissociate
numero
di moli dissociate
![]() numero
di ioni derivati da
numero
di ioni derivati da ![]() moli
dissociate
moli
dissociate
Il numero totale di moli di particelle, dato dalla somma delle molecole rimaste indissociate e dagli ioni formatisi per dissociazione è dunque:
![]()
L'espressione in parentesi quadra viene solitamente indicata con la lettera
i ed è chiamata coefficiente di
Van't Hoff , rappresenta il numero per il quale va moltiplicato
il numero di moli che si avrebbe in assenza di dissociazione per ottenere
il numero totale di moli di particelle (molecole+ioni) presenti in una
soluzione.
Ad esempio nel caso dell'innalzamento ebulloscopico si avrebbe:
![]()
 edutecnica
edutecnica