Esercizio 6
In un reattore con V=10 l a vuoto spinto, reagiscono
0,5 moli di H2 con altrettante di I2 alla temperatura
di 440°C, con un Kc=50.
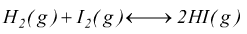
— quanto vale il Kp?
— quale è la pressione totale della camera?
— quante sono le moli di iodio che non hanno reagito e rimangono
all'equilibrio?
— quale è la pressione parziale di ciascun componente della miscela
all'equilibrio?
[ 50 | 5,85 atm | 0,11 moli | pH2=pI2=0,64 atm PHI=4,65 atm ]
 edutecnica
edutecnica