Equilibrio
La maggior parte delle reazioni chimiche non comporta la completa trasformazione
di reagenti in prodotti.
Dall'esperienza si nota che solo in alcuni casi le reazioni chimiche decorrono
in modo completo, mentre in altri casi esse si arrestano senza completarsi.
Vi sono alcune reazioni nelle quali lo stato finale è costituito solo dai prodotti, e da altre nelle quali in esso sono presenti anche quantità più o meno rilevanti di sostanze reagenti.
Quindi, si può dire che se non intervengono altri fattori, nessuna
reazione porta al completo annullamento delle sostanze reagenti, ma lo
stato finale è sempre caratterizzato dalla presenza simultanea
di tutte le sostanze partecipanti al processo.
Quando questo si verifica si può dire che stato è raggiunto lo
stato di equilibrio.
Vi sono due modi di immaginare questo stato: o ammettendo che in esso
non si svolga più alcuna reazione, o ammettendo invece che in esso avvengano
due reazioni opposte con la stessa velocità.
Agli effetti pratici il risultato sembra identico tuttavia la seconda
interpretazione risulta quella esatta.
È possibile paragonare l'equilibrio chimico al passaggio di stato fra liquido e vapore in un recipiente chiuso, dove il processo di evaporazione è quello di condensazione avvengano contemporaneamente alla stessa velocità. Per lo stesso motivo si parla anche di reazioni reversibili e si usa una rappresentazione con due frecce dirette in senso opposto per indicare che esse possono svolgersi in entrambi i sensi.
![]()
Tutti questi aspetti vengono riassunti e quantizzati in una legge che
stabilisce un rapporto tra le concentrazioni delle sostanze che partecipano
al mantenimento dell'equilibrio chimico.
Si tratta della legge dell'azione di massa che
riferita alla precedente reazione (ad una determinata temperatura) si
scrive :
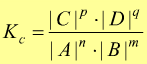
dove le concentrazioni sono quelle delle specie chimiche all'equilibrio.
Se le concentrazioni non sono quelle all'equilibrio, il rapporto fra le
concentrazioni viene chiamato quoziente di reazione ed indicato con la
lettera Q.
In un equilibrio chimico a temperatura costante, il rapporto tra il prodotto delle concentrazioni molari delle sostanze formatesi e quello delle sostanze reagenti, elevate ciascuna ad un esponente pari al proprio coefficiente stechiometrico, è costante.
La costante Kc viene chiamata costante di equilibrio; essa dipende soltanto dalla temperatura.
Quando la reazione avviene fra sostanza gassose si può esprimere la costante di equilibrio come il rapporto tra le pressioni parziali. La costante che si ottiene viene detta Kp:
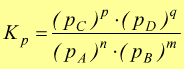
Infatti si vede come per la reazione ![]() considerando le concentrazioni in mol/l
considerando le concentrazioni in mol/l
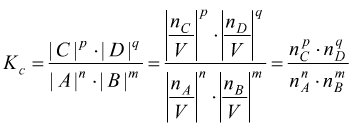 mentre
mentre
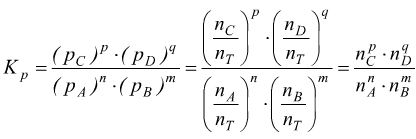
dalla legge dei gas si ricava poi
![]()
Equilibrio di solubilità di un sale
Assegnata la reazione di dissociazione di un sale in acqua :
![]()
Nel caso in cui sia presente del corpo di fondo AaBb(s). Si definisce costante di equilibrio ( o prodotto di solubilità ).
![]()
Viene definita la solubilità S di un
sale come la concentrazione della soluzione satura ( soluzione in equilibrio
col corpo di fondo ) in mol/l o mg/l.
La solubilità di un sale dipende dalla temperatura T, dalla presenza di
ioni comuni e dal PH (qualora la dissociazione del sale generi specie
che si comportano da acidi o da basi deboli).
A temperatura costante ed in acqua pura il Kps e la
solubilità molare (S) sono correlati fra loro dalla seguente relazione
:
![]()
 edutecnica
edutecnica