Aria
L'aria è l'insieme dei gas che avvolgono il nostro pianeta e vi aderiscono per effetto della gravità. La sua composizione è variabile in base a diversi fattori, tra cui l'altitudine e le immissioni di gas che vengono fatte in essa. In questa pagina vengono elencate alcune proprietà che caratterizzano questa miscela gassosa:
Proprietà
Mediamente i gas, i vapori e le sospensioni particellari che la costituiscono si trovano secondo le proporzioni percentuali (in volume) elencate nella tabella seguente. Questa si riferisce ad aria secca, cioè privata del vapore acqueo, perché questo si trova in proporzioni troppo variabili con la località, col tempo e con la temperatura.
| Composizione media dell'aria secca | |
| Componenti | Volume % |
| azoto | 78,09 |
| ossigeno | 20,95 |
| argo | 0,92 |
| anidride carbonica | 0,035 |
| idrogeno | 0,01 |
| neon | 0,0016 |
| elio | 0,0005 |
| metano | 0,0002 |
| kripto | 0,0001 |
| xeno | 0,00006 |
Vicino alla superficie terrestre (livello del mare) un litro d'aria pesa in media 1,29305 g a 0°C e a 760 Torr (1 atm) . La composizione percentuale media dell'aria, sempre a livello del mare, è la seguente:
75,3% N2
23% O2
0,26% H2O (vapore)
0,04% CO2
1,4% He, Ne, Ar, Kr, Xe, Rn
La pressione a cui è sottoposta l'aria è determinata per ogni strato dagli
strati che la sovrastano, pertanto essa va decrescendo con legge non lineare
al crescere dell'altitudine. A livello del mare oscilla mediamente intorno
a 101.325 Pa (1 atm o 1,01325 bar), per ridursi a 0,03 Pa a un'altitudine
di 100 km.
L'andamento della densità è del tutto simile.
L'andamento della temperatura, invece, è molto complesso perché dipende
dagli eventi che si verificano a varie quote e quindi dal diverso assorbimento
della radiazione solare e dei raggi cosmici da parte delle molecole e ioni
che popolano i vari strati.

Importanza biologica dell'aria
Tutti i componenti dell'aria, all'infuori dei gas nobili, sono fondamentali
per la vita sulla Terra.
Il vapor d'acqua consente, tra l'altro, che gli esseri viventi non muoiano
per progressiva disidratazione dei loro tessuti.
L'ossigeno, l'azoto e l'anidride carbonica vengono variamente utilizzati
dagli animali e dalle piante: l'ossigeno attraverso la respirazione, l'azoto
per nitrificazione del suolo agrario, da dove poi passa negli animali attraverso
i vegetali.
L'anidride carbonica, infine, è il principale reagente della sintesi clorofilliana
utilizzata dai vegetali. Gli stessi componenti dell'aria vengono restituiti
all'ambiente alla fine d'una serie di cicli vitali.
Importanza tecnologica dell’aria
Anche dal punto di vista tecnologico molti componenti dell'aria rivestono un interesse grandissimo od almeno notevole.
Tutte le combustioni industriali, responsabili della massima parte dell'energia
prodotta sulla Terra, sfruttano l'ossigeno dell'aria: tal quale o dopo averlo
ottenuto puro.
L'ossigeno inoltre, come già visto,
trova anche molti altri usi. L'azoto è un elemento base della moderna chimica
industriale, soprattutto perché attraverso esso si producono l'ammoniaca,
l'acido nitrico e i loro derivati. Esiste anche il problema di ottenere
puri questi gas. Allo scopo dopo averla essiccata e privata dell'anidride
carbonica (per gorgogliamento in soda caustica, che reagendo con CO2 si
trasforma in Na2CO3), l'aria viene fortemente compressa, raffreddata e poi
lasciata espandere. In tal modo condensa, originando un liquido trasparente
e bluastro: l'aria liquida.
Aria liquida
L'aria liquida ha proprietà fisiche particolari data la sua bassa temperatura. Non può essere conservata in recipienti chiusi se non sotto enormi pressioni e buon isolamento termico. Si può tenere in recipienti isolati ma aperti solo per qualche ora o per qualche giorno, a seconda della quantità. Essa infatti è soggetta a continua ebollizione. I suoi vapori fumano all'aria perché, per l'abbassamento di temperatura che provocano, fanno condensare il vapor d'acqua e l'anidride carbonica presenti nell'ambiente. Tutti i liquidi a temperatura ambiente, immersi in aria liquida, si solidificano e i solidi (legno, piante) vi divengono fragilissimi. I metalli poi, a contatto con l'aria liquida, diventano superconduttori.
L'aria liquida è una miscela d'azoto, d'ossigeno e di gas nobili. Se questi
non vengono espressamente ricuperati, ritornano nell'aria normale durante
i cicli di utilizzazione dell'azoto e dell'ossigeno, perché essi non entrano
in combinazione.
Del loro ricupero tratteremo dopo, mentre per ora li trascuriamo. In un
contenitore aperto la temperatura dell'aria liquida è di circa 195°C, punto
d'ebollizione dell'azoto liquido. Una tale temperatura resta pressoché costante,
mentre l'azoto si trasforma lentamente in vapore (il fenomeno appare proprio
come un processo d'ebollizione, nonostante la temperatura estremamente bassa
a cui si verifica).
Così è possibile ottenere azoto ad alto grado di purezza, adatto per sintesi
chimiche industriali.
La temperatura d'ebollizione dell'aria liquida, una volta che è rimasto
l'ossigeno praticamente puro, si alza verso i -182 °C, punto d'ebollizione
dell'ossigeno. Così questo può, a sua volta, essere raccolto quasi puro.
L'aria liquida si conserva in enormi bottiglie isolanti (vasi Dewar ) con
limitata apertura (non è possibile chiudere i contenitori se non sotto enormi
pressioni o garantendo una efficiente refrigerazione che impedisca all'aria
di evaporare).
L'aria liquida viene sfruttata pure nella tecnica dell'ottenimento delle
basse temperature (richiesta ad es. nella tempra forte degli acciai) e,
lasciata arricchire di ossigeno, l'aria liquida si impiega perfino nella
fabbricazione di esplosivi.
Gas nobili
I gas nobili presenti nell'aria ( He, Ne, A, Kr, Xe, Rn) sono sei elementi
chimici gassosi che a temperatura ordinaria, reagiscono con grande difficoltà
data la loro particolare struttura elettronica.
I composti dei gas nobili che sono stati ottenuti, in singolari condizioni,
in questi ultimi anni, sono poco stabili. Per questo motivo si continua
ancora a parlare di gas inerti.
Le principali caratteristiche chimico-fisiche dei gas nobili sono schematizzate nella seguente tabella:
| Nome | Z | Peso atomico | Temp. critica | Pressione critica | PE | PF | Solubilità in acqua | Raggio atomico |
| Elio | 2 | 4,0026 | -267,9°C | 2,26 atm | -269,9°C | -272,1°C | 9,4 cc/l | 0,93 |
| Neon | 10 | 20,183 | -228,7°C | 26,9 atm | -246,0°C | -248,1°C | 11,6 cc/l | 1,12 |
| Argo | 18 | 39,948 | -122,4°C | 50,6 atm | -185,8°C | -189,4°C | 34,7 cc/l | 1,54 |
| Cripto | 36 | 83,80 | -63,6°C | 54,3 atm | -152,9°C | -156,6°C | 60 cc/l | 1,69 |
| Xeno | 54 | 131,30 | + 16,6°C | 58,2 atm | -107,1°C | -111,5°C | 125 cc/l | 1,9 |
| Radon | 86 | 222 | +104,5°C | 62,4 atm | -65°C | -71°C | 224 cc/l | - |
I gas nobili vengono ottenuti prevalentemente in America da varie sorgenti
gassose naturali; più generalmente però si ricavano dall'aria. Lo schema
sopra riportato prospetta il complesso dei trattamenti a cui dev'essere
assoggettata l'aria per ottenerne i gas nobili.
L'elio si usa qualora occorra ancora riempire aerostati
e palloni sonda (è un po' meno leggero dell'idrogeno, ma in compenso non
è combustibile). Si usa anche in tubi luminescenti, dove fornisce una bella
luce gialla; ma è soprattutto importante nella creazione di atmosfere isolanti
e inerti in apparecchiature tecnico- scientifiche.
Il neon, portato all'incandescenza, dà una bella
luce rosso-arancio, molto penetrante anche nella nebbia. Si usa perciò in
insegne luminose.
L'argo è il più economico dei gas nobili, perchè
è di gran lunga il più abbondante di tutti nell'aria.
L'argo, mescolato al 15% di azoto, serve per evitare la volatilizzazione,
per sublimazione, dei filamenti delle lampadine elettriche.
L'argo poi dà luogo ad una gamma di colorazioni se viene reso incandescente:
a meno di 1 Torr di pressione fornisce luce blu, a 5 Torr dà luce rossa
e appena sopra i 10 Torr fornisce luce verde.
Il cripto e lo xeno danno,
rispettivamente, luce verde bluastra e verde-violacea. Sono poi questi i
gas nobili di cui si conosce finora il maggior numero di composti, preparati
con speciali tecniche in laboratorio.
Il radon è molto scarso in natura, dove si forma
dalle disintegrazioni radioattive e dove scompare tramutandosi, a sua volta,
in altri elementi.
Effetto serra
L'ossigeno è presente negli strati bassi dell'atmosfera (troposfera e bassa
stratosfera) come molecola biatomica, O2. È il diossigeno che
gli esseri viventi respirano e che alimenta le combustioni.
Nello strato alto della stratosfera, al confine con la mesosfera, è presente
un sottile strato di ossigeno triatomico (ozono, O3) che viene
scisso dalla radiazione solare compresa tra 200 nm e 330 nm (UV ultravioletto)
in diossigeno e monoossigeno:
![]()
Lo strato di ozono quindi assorbe la radiazione UV più energetica e lascia passare soltanto quella del vicino UV, del visibile e dell'IR (infrarosso). L'ozono dal canto suo, data l'instabilità dell'ossigeno monoatomico, si riforma e riemette sotto forma di calore l'energia assorbita prima:
![]()
Per questo motivo, a 50 km d'altitudine la temperatura è più alta di quella
della bassa stratosfera e della mesosfera. Lo strato di ozono è distrutto
da sostanze radicali che che originano dai fluoroclorocarburi e dagli scarichi
dei jet.
Si sta formando ed estendendo per questo sull' Antartide il cosiddetto buco
d'ozono, che è un evento catastrofico dalle conseguenze ancora non del tutto
chiarite. Nella troposfera, il diossigeno partecipa a un ciclo che lo coinvolge
insieme con il suo antagonista, il diossido di carbonio. Grazie alla fotosintesi
clorofilliana:
![]()
esso viene restituito all'atmosfera, dalla quale viene prelevato per le combustioni e per la respirazione dei viventi, che danno CO2 come prodotto. Altri equilibri secondari, quali l'assorbimento e il rilascio di CO2 dalla componente basica della crosta terrestre o dalle acque in cui è solubilizzato, fanno sì che i tassi di O2 e di CO2 nell'atmosfera si mantengano costanti. Però ciò avviene a condizione che non ci si allontani eccessivamente da una situazione di saldo in pareggio; in parole povere, che non si distrugga indiscriminatamente il patrimonio forestale e boschivo e che non si facciano crescere oltre ogni limite le effusioni di CO2 nell'aria.
Gli effetti dell'aumento del tasso di CO2 sono legati al comporta- mento termico di questo gas. Le molecole di CO2, trasparenti alla luce visibile, assorbono le radiazioni infrarosse (la radiazione termica) e le irradiano in tutte le direzioni. Pertanto il calore riemesso dal suolo terrestre e dalle superfici d'acqua verso lo spazio viene in parte bloccato da CO2 presente e riemesso in ogni direzione, quindi in parte di nuovo sulla Terra. Il diossido di carbonio si comporta quindi come una superficie semiriflettente del tipo di quelle che si usano nelle serre. Questo effetto viene perciò definito effetto-serra ed è destinato a provocare un progressivo aumento della temperatura media del pianeta.
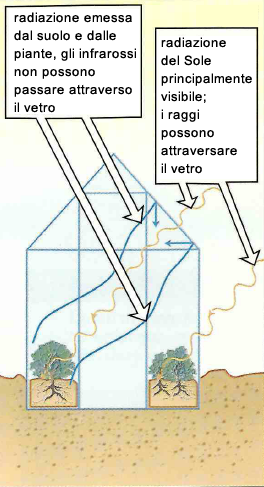
Possibili rimedi sono: salvaguardia e incremento su grande e piccola scala della vegetazione e limitazione delle immissioni di CO2 nell'atmosfera.
Inquinamento dell'aria
I principali inquinanti dell'aria sono: il diossido di zolfo (SO2); il monossido di carbonio (CO); gli ossidi d'azoto (NO e NO2); l'ozono (O3); i fumi. Il diossido di zolfo origina dalla presenza di impurezze contenenti zolfo che si accompagnano al petrolio e al carbon fossile; il metano invece ne è esente. Questo gas provoca malattie respiratorie, ma la sua dannosità non si limita a questo. Infatti, all'aria esso si ossida e si idrata per dare acido solforico:
![]()
Questo composto condensa sotto forma di microgocce che rimango- no sospese
o vengono disciolte dall'acqua piovana rendendola forte- mente acida (piogge
acide).
Queste precipitazioni, al suolo o nei bacini acquosi, provocano ingenti
danni: defoliazione e morte delle piante, ossidazione e corrosione di strutture
metalliche e lapidee, morìa di pesci e di altre forme di vita acquatiche.
Rimedi a valle all'azione devastante delle piogge acide non sono realizzabili,
tenuto conto che esse si manifestano anche a notevole distanza dal luogo
di formazione, a causa dell'azione di trasporto operata dai venti. L'unico
rimedio è a monte: dotare i camini di sostanze basiche che assorbano SO2
e utilizzare comunque camini molto alti che ne favoriscano una buona dispersione
in grandi volumi d'aria. L'elevata temperatura che si raggiunge nelle combustioni
provoca la formazione di CO, NO e O3 a causa della endotermicità
delle reazioni di formazione di questi composti.
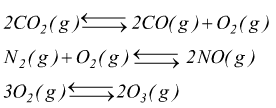
Poiché quindi nelle condizioni operative gli equilibri sono spostati verso destra, è difficile intervenire per ridurre la produzione di questi inquinanti. È possibile invece sfruttare il loro diverso carattere: NO e O3 sono ossidanti, CO è riducente. Tuttavia la reazione di ossidazione di CO ad opera di NO o di O3 è lenta:

Il rimedio consiste quindi nel renderla veloce mediante l'uso di appropriati catalizzatori. La marmitta catalitica è un esempio di applicazione di questo espediente per contrastare l'inquinamento di origine veicolare.
 edutecnica
edutecnica