Termologia
Quando mettiamo a contatto due corpi che si trovano a differente temperatura, il calore tenderà a fluire dal corpo più caldo a quello più freddo. Il passaggio di calore non è altro che un trasferimento di energia da un sistema ad un altro.
L'equivalenza tra lavoro ed energia fu dimostrata sperimentalmente nel 1847 da J.P.Joule.
Nel dispositivo di Joule la caduta per gravità di una massa provoca la rotazione delle pale di un agitatore collocato in un calorimetro (un contenitore molto leggero ed isolato termicamente). Il calore prodotto all'interno del contenitore è pari alla differenza tra l'energia potenziale iniziale e l'energia cinetica finale della massa m. L'esperimento viene eseguito in più battute e il termometro, alla fine, rivela un aumento di temperatura causato dal lavoro compiuto dalla forza di gravità che, facendo scendere la massa, fa ruotare l'agitatore.
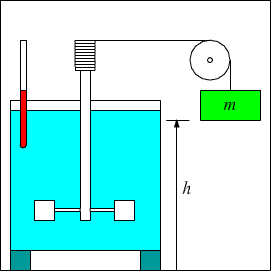
La sua conclusione fu che calore e lavoro sono equivalenti e possono essere considerati due modi per trasferire energia da un sistema ad un altro.
Il calore si indica con la lettera Q e consiste in una variazione di energia.
Q=ΔE entrambe le grandezze si misurano in Joule.
Capacità termica
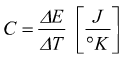
La capacità termica di un corpo è uguale alla quantità di energia che permette di innalzare di 1°K la sua temperatura.
Calore specifico
La capacità termica dipende dalla sostanza di cui è costituito il corpo e dalla sua massa.
![]()
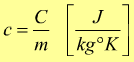
La grandezza c individuata è denominata calore specifico.
Il calore specifico è uguale alla quantità
di energia necessaria per aumentare di di 1°K la tempreatura di 1kg
della sostanza considerata.
Combinando le uguaglianze precedenti si ottiene
![]()
![]()
L'ultimo passaggio è ottenuto considerando che l'energia è scambiata come flusso di calore.
Caloria
La caloria è una misura del calore alternativa al Joule (adottato nel
S.I.). Una caloria è pari alla quantità di energia necessaria per innalzare
la temperatura di 1g di acqua distillata da 14,5°C a 15,5°C a pressione
atmosferica normale.
1 cal=4,186 J
In base a questa definizione la quantità di energia necessaria per
innalzare di 1°K la temperatura di 1kg di acqua è di 4186J=4,186 kJ
e questo valore corrisponde dunque al calore specifico dell'acqua
| Calore specifico a pressione costante (P=1bar) | |
| Sostanza | c [kJ/kg°K] |
| Acqua | 4,186 |
| Alluminio | 0,896 |
| Alcool | 2,432 |
| Ammoniaca | 1,670 |
| Anidride carbonica | 0,820 |
| Argento | 0,234 |
| Aria (273°K) | 1,025 |
| Azoto | 1,038 |
| Bromo | 0,171 |
| Bronzo | 0,384 |
| Calcestruzzo | 0,880 |
| Carbonio | 0,850 |
| Cemento | 0,752 |
| Elio | 5,232 |
| Ferro/acciaio | 0,456 |
| Ghiaccio (273°K) | 2,093 |
| Ghisa | 0,440 |
| Glicerina | 2,427 |
| Gomma | 1,400 |
| Grafite | 0,720 |
| Idrogeno(273°K) | 14,300 |
| Iodio | 0,145 |
| Legno | 2,700 |
| Mattoni | 0,860 |
| Mercurio | 0,140 |
| Nafta | 2,052 |
| Oro | 0,129 |
| Ossigeno(273°K) | 0,921 |
| Ottone | 0,380 |
| Piombo | 0,129 |
| Rame | 0,387 |
| Sodio | 1,230 |
| Sughero | 2,000 |
| Stagno | 0,228 |
| Vapore d’acqua(273°K) | 2,000 |
| Vetro | 0,840 |
| Zinco | 0,390 |
La tabella precedente è certamente valida per i corpi che si trovano
allo stato solido.
Per gli aeriformi, che non hanno un volume proprio, questa condizione
non è scontata; cioè lo scambio termico può avvenire mantenendo la pressione
costante oppure il volume costante; bisogna dunque specificare indicando
cp=calore specifico a pressione costante.
cv=calore specifico a volume costante.
Valori indicativi del cv per alcuni gas
| Gas | cv (kJ/kg°K) |
| Aria (fino a 300°C) | 0,717 |
| Elio | 3,14 |
| Ossigeno | 0,649 |
| Idrogeno | 10,13 |
| Ossido di carbonio | 0,72 |
| Azoto | 0,737 |
| Anidride carbonica | 0,67 |
| Ammoniaca | 1,716 |
| Metano | 1,925 |
| Vapore (fino a 100°C) | 1,549 |
Temperatura di equilibrio
Se si scaldano due corpi di materiale diverso con la stessa quantità di calore Q, si nota che essi assorbono il calore in modo diverso e acquisiscono temperature diverse. Per ogni tipo di materiale vale, infatti, la legge:
![]()
Q=Quantità di calore scambiato in Joule (J)
m=massa del corpo in kg
c=calore specifico del materiale in J/kg°K
Ti=temperatura iniziale in Kelvin °K
Tf=temperatura finale in Kelvin °K
Questa formula viene spesso usata per determinare la temperatura di
equilibrio finale di due corpi, uno caldo ed uno freddo che raggiungono
l'equilibrio termico, scambiandosi la quantità di calore Q. Assumendo
che il corpo caldo 2, alla temperatura T2, ceda la quantità
di calore
![]()
per raggiungere la temperatura di equilibrio Te; e assumendo che questa quantità di calore venga assorbita dal corpo 1 alla temperatura T1 ccon T2>T1.
![]()
uguagliando le due equazioni si ottiene:
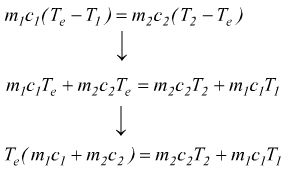
in definitiva la temperatura di equilibrio sarà:
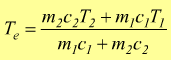
Qui sotto possiamo calcolare, tenendo conto che eventuali calori specifici vanno inseriti in kJ/kg°K.
|
||||||||||||||||||||||||||
Passaggi di fase
Una fase è una porzione omogenea di un sistema separata dal resto del sistema da contorni definiti. In questo caso si fa il solito esempio del cubetto di ghiaccio nel bicchiere d'acqua. L'intero sistema è di acqua, ma una sua parte (il cubetto) è di ghiaccio cioè si trova in fase solida, mentre il resto del sistema è in fase liquida.
La materia si può presentare in tre stati di aggregazione diversi: fase solida,fase liquida e fase aeriforme ( o gassosa).
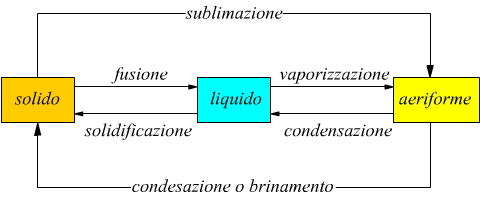
Tramite scambi di calore si può ottenere il passaggio da uno stato di aggregazione all'altro.
Passaggio di fase solido-liquido
Come si vede dallo schema sopra riportato questo passaggio di stato può avvenire con la fusione di un solido verso un liquido oppure tramite un processo inverso che viene chiamato solidificazione e che si ha quando un liquido raffreddandosi si porta allo stato solido.
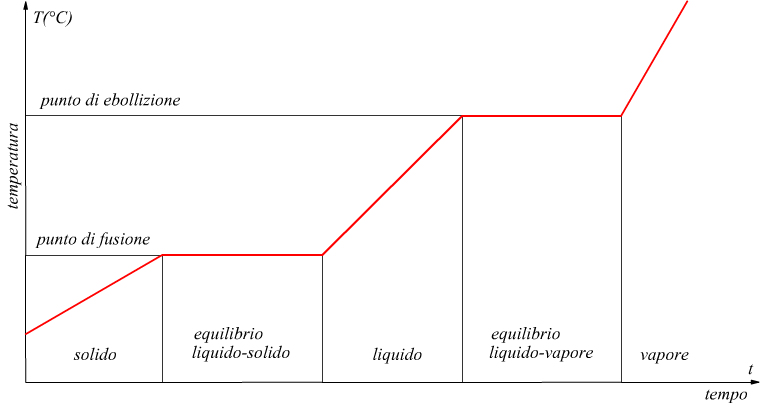
Se forniamo calore ad un oggetto solido ad esempio ad un blocco di
ghiaccio, questo dapprima si riscalda.
Ad un certo punto, il ghiaccio inizia a liquefarsi:questo fenomeno è
chiamato fusione. La fusione di un corpo solido ha le seguenti caratteristiche.
1) Ad una data pressione, per ogni sostanza la fusione avviene ad una
temperatura determinata detta temperatura di fusione di quella sostanza.
2) Durante tutto l'intervallo di tempo in cui avviene la fusione di
un corpo la sua temperatura si mantiene costante.
3) L'energia necessaria per fondere completamente una massa m di una
data sostanza che si trova già alla temperatura di fusione,è direttamente
proporzionale ad m.
![]()
Lf è detta calore latente di fusione [J/kg]. ΔE [J
] è l'energia che deve essere fornita per far fondere la massa m arrivata
alla temperatura di fusione.
Trattandosi di un processo che avviene a pressione costante, può essere
indicato come una variazione di entalpia ΔHf [J].
![]()
Le stesse considerazioni valgono per il processo inverso cioè la solidificazione. La temperatura di solidificazione per ogni sostanza è uguale a quella di fusione.
![]()
Si può specificare che
fusione: ΔEf > 0 perchè l'energia è fornita dall'ambiente
al sistema.
solidificazione: ΔEf < 0 perchè l'energia è ceduta
dal sistema all'ambiente.
Qui alcuni calori latenti di fusione e corrispondenti temperature di fusione per alcune sostanze.
| Sostanza | T.fusione (°C) | Lf Calore latente di fusione (kJ/kg) |
| Idrogeno | -259 | 56,8 |
| Azoto | -210 | 25,5 |
| Ossigeno | -219 | 13,8 |
| Alcol etilico | -114 | 104 |
| Mercurio | -39 | 11,8 |
| Acqua | 0 | 334 |
| Zolfo | 119 | 38 |
| Piombo | 328 | 23 |
| NaCl | 808 | 500 |
| Argento | 961 | 109 |
| Quarzo | 1607 | 200 |
Passaggio di fase liquido-vapore
Abbiamo visto attraverso l'equazione
di Clapeyron che la tensione di vapore ( o pressione di vapor saturo)
di un liquido aumenta con la temperatura.
Quando la tensione di vapore uguaglia la pressione esterna, il liquido
bolle.
Il punto ( temperatura) di ebollizione di
una sostanza è definito come la temperatura alla quale la sua tensione
di vapore diventa uguale alla pressione esterna.
Si conclude che il punto di ebollizione di
una sostanza dipende dalla pressione esterna.
Ad es. in montagna la pressione esterna è inferiore a quella che si
ha a livello del mare, dunque in montagna la temperatura di ebollizione
sarà inferiore a quella registrata in riva al mare.
Anche per l'ebollizione di un liquido valgono le leggi sperimentali
viste prima :
1) a una data pressione,per ogni liquido l'ebollizione avviene
ad una temperatura determinata,detta temperatura di ebollizione;
2) durante tutto l'intervallo di tempo in cui avviene l'ebollizione
di un liquido,la sua temperatura si mantiene costante;
3) l'energia necessaria per trasformare in vapore l'intera massa m di
un liquido, che si trova già alla temperatura di ebollizione, è direttamente
proporzionale ad m.
Quest'ultima formulazione può essere espressa come:
![]() energia
di vaporizzazione [ J ]
energia
di vaporizzazione [ J ]
Lv è detta calore latente di vaporizzazione [ J/kg ].
E [ J ] è l'energia che deve essere fornita per far vaporizzare la massa
m arrivata alla temperatura di ebollizione. Come detto prima, sarebbe
più appropriato parlare di variazione entalpica ΔHv
[ J ].
![]()
Anche in questa circostanza il processo inverso:la condensazione può essere descritto dalla stessa formula ricordando che
vaporizzazione: ΔEv > 0 perchè l'energia è fornita
dall'ambiente al sistema.
condensazione: ΔEv < 0 perchè l'energia è ceduta
dal sistema all'ambiente.
![]()
Qui alcuni calori latenti di vaporizzazione e corrispondenti temperature di ebollizione per alcune sostanze.
| Sostanza | T.ebollizione (°C) | Lv Calore latente di vaporizzazione (kJ/kg) |
| Elio | -269 | 21 |
| Idrogeno | -253 | 452 |
| Azoto | -196 | 201 |
| Ossigeno | -183 | 213 |
| Etere etilico | 35 | 377 |
| Alcol etilico | 78 | 854 |
| Acqua | 100 | 2253 |
| Mercurio | 357 | 295 |
| Zolfo | 445 | 327 |
| Piombo | 1750 | 871 |
| Argento | 2193 | 2336 |
Diagrammi di stato
La correlazione tra le fasi alle quali può esistere una data sostanza può essere rappresentato con un grafico chiamato diagramma di stato. Dato che le variabili termodinamiche che consideriamo sono PVT (pressione, volume, temperatura) i diagrammi significativi sono almeno due: il diagramme PV noto come piano di Clapeyron e il diagramma PT. Ad esempio, qui sotto è disegnato il diagramma PV per la CO2.
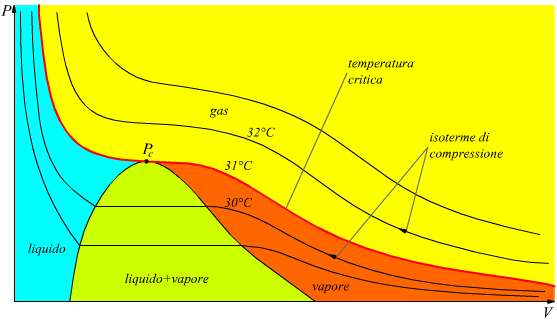
Nel diagramma è evidente la curva della temperatura critica (in rosso) a 31°C che separa la fase gassosa dalle restanti fasi; le altre linee sono rappresentative dell'andamento delle isoterme. Per definizione si definisce un gas una specie chimica gassosa che si trova al di sopra della sua temperatura critica. Si definisce vapore una specie chimica gassosa che si trova al di sotto della sua temperatura critica.
Ipotizzando di comprimere una sostanza a temperatura costante (seguendo le linee delle isoterme da destra verso sinistra) la differenza tra gas e vapore è evidente:
•Un vapore è liquefacibile per compressione.
•Un gas non è liquefacibile per compressione.
Anche altre sostanze presentano un andamento analogo, ad esempio qui sotto è riportato il diagramma di stato dell'acqua con le sue tre coordinate termodinamiche con la curva della temperatura critica a 374,1°C.
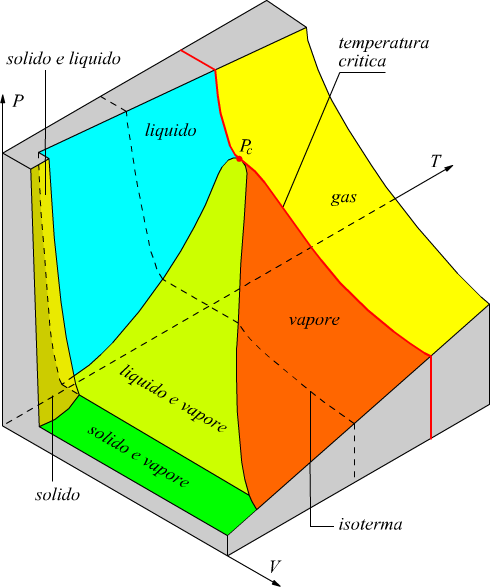
Da quest'ultimo disegno si può constatare che i passaggi di fase possono essere descritti anche attraverso la rappresentazione sul piano PT.
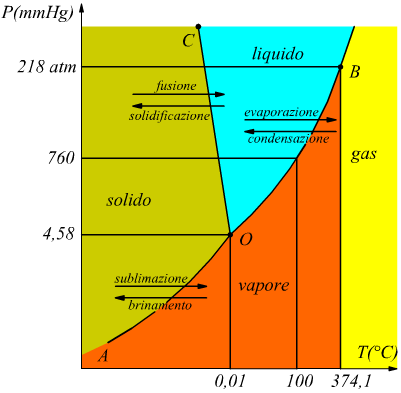 La
linea AO rappresenta la variazione della pressione di vapore del ghiaccio
con la temperatura; essa può avere inizio dai dintorni dello zero assoluto
e cessa con la fusione del ghiaccio a 0,01°C: il suo andamento segue
l'equazione di Clapeyron; dunque, il tratto AO rappresenta i valori
di temperatura e pressione ai quali si può trovare in equilibrio il
sistema costituito da ghiaccio e vapore o anche i valori di temperatura
e pressione ai quali il ghiaccio sublima.
La
linea AO rappresenta la variazione della pressione di vapore del ghiaccio
con la temperatura; essa può avere inizio dai dintorni dello zero assoluto
e cessa con la fusione del ghiaccio a 0,01°C: il suo andamento segue
l'equazione di Clapeyron; dunque, il tratto AO rappresenta i valori
di temperatura e pressione ai quali si può trovare in equilibrio il
sistema costituito da ghiaccio e vapore o anche i valori di temperatura
e pressione ai quali il ghiaccio sublima.
La linea OB inizia a 0,01°C e termina a 374,1°C: temperatura critica dell'acqua; ogni coppia di valori PT appartenenti a questa curva individua degli stati di equilibrio liquido-vapore.Il punto critico Pc individuabile nel diagramma PV può essere assimilato al punto B a 218 atm.
La linea OC , inizia a 0,01°C e a 4,58 mmHg, rappresenta la variazione di temperatura di fusione del ghiaccio al variare della pressione esterna al sistema; anch'essa segue l'equazione di Clapeyron. Su questa linea, si hanno gli stati di coesistenza tra ghiaccio ed acqua. Questa linea, ha una pendenza esageratamente accentuata, solo per rendere evidente che la temperatura di fusione del ghiaccio diminuisce all'aumentare della temperatura.
Dall'analisi dei diagrammi si deduce che per condensare un vapore ci sono due opzioni
1) lo si può comprire mantenendo costante la temperatura;
2) lo si può raffreddare mantenendo costante la pressione.
 edutecnica
edutecnica