pH
Il pH è una scala di misura che indica il grado di acidità o basicità di una soluzione acquosa. Essa va da 0 a 14, dove 0 indica un'elevata acidità, 7 indica una soluzione neutra e 14 indica un'elevata basicità.
Una base, è una specie chimica in grado di acquisire
un protone che gli viene ceduto da un acido.
Un acido è una specie chimica in grado di cedere un protone, accettato
da una base.
Un protone, non può esistere in forma isolata; un acido si manifesta
come tale solo se è in presenza di una base che possa accettarne il protone.
In modo analogouna base si manifesta come tale solo in presenza di un
acido che possafornirgli il protone.
Si deduce che si ha a che fare con sistemi acido-base piuttosto che di
acidi e basi presi singolarmente.
Ad esempio, l'acqua ha sempre una piccola quantità di molecole dissociate in ioni H3O+ ed OH- secondo l'equilibrio:
![]()
La costante Kw detta prodotto ionico dell'acqua vale
![]()
dove con |H3O+| e|OH-| sono indicate le concentrazioni molari delle rispettive specie ioniche.
Le soluzioni con |H3O+|=|OH-|=10-7
[mol/l] sono dette soluzioni neutre .
Le soluzioni con |H3O+| > |OH-| sono
dette soluzioni acide.
Le soluzioni con |H3O+| < |OH-| sono
dette soluzioni basiche,
Trattandosi di quantità sempre molto piccole è vantaggioso usare una
notazione logaritmica per indicare il grado di acidità o basicità di una
soluzione.
Si usa esprimere la concentrazione degli ioni H3O+
tramite il pH definito come:
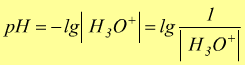
in modo analogo si definisce la misura degli ioni OH- di una soluzione tramite il pOH:
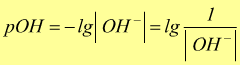
Dove la base del logaritmo è 10 ( n.d.r. )
Per definizione a T=25°C gli acidi hanno pH
< 7 , le basi hanno un pH > 7; la somma del pH e del pOH è 14.
E' possibile classificare acidi e basi in:
— acidi e basi forti: completamente dissociati in acqua
— acidi e basi deboli: si ha un equilibrio fra reagenti e prodotti.
Per il calcolo del pH di soluzioni di acidi e basi deboli è necessario
conoscere anche la costante di dissociazione K.
Dato che acidi forti ( basi forti ) sono completamente dissociati in acqua
le concentrazioni H3O+ per essi
( OH- per le basi ) risultano uguali alle concentrazioni iniziali
degli acidi ( o delle basi ).
Bisogna poi considerare che per acidi (basi) molto diluiti M << 10-7 non si può trascurare il prodotto di dissociazione dell'acqua in questo caso si applica la correzione:
![]() oppure
oppure ![]()
indicando con Ma e Mb rispettivamente la concentrazione molare dell'acido o della base.
Esempi di acidi forti sono HClO4 , H2SO4,
HI, HCl, HNO3.
Tutti gli idrossidi dei metalli alcalini sono, invece, basi forti.
 edutecnica
edutecnica