Nomenclatura chimica
Ogni specie chimica viene indicata con una formula
e con un nome.
La formula descrive la composizione della sostanza in modo univoco.
La nomenclatura è l'insieme delle regole per denominare (assegnare
un nome) al composto, in modo che si possa ricostruirne con precisione la
formula.
Un organismo internazionale: l'International Union of Pure and Applied Chemistry
( IUPAC ) provvede a definire e ad aggiornare tutti i dati riguardanti la
la denominazione delle varie specie chimiche.
Ciò nonostante, a causa di un certo conservatorismo nel linguaggio
dei chimici, molti composti vengono ancora, usualmente indicati con nomi
tradizionali (antiquati) fuori dalle regole della nomenclatura razionale
moderna; per quanto possibile noi vi faremo, comunque, richiamo.
Composti binari
Le forme più semplici di nomenclatura si hanno considerando i composti binari cioè le sostanze formate da due elementi diversi.
Per dare un nome ai composti binari, si parte generalmente dal secondo elemento che appare nella formula cambiando la desinenza ( o postfisso) del suo nome in -uro; ad es. in HF il secondo elemento è il fluoro, quindi si cambia il nome da fluoro a fluoruro e poi si aggiunge il nome del primo elemento preceduto dalla preposizione di. Quindi il nome sistematico di HF è:
HF=fluoruro di idrogeno
Allo stesso modo
HCl=cloruro di idrogeno
o come
SiC=carburo di silicio
| Prefisso | Numero |
| Mono | 1 |
| Di | 2 |
| Tri | 3 |
| Tetra | 4 |
| Penta | 5 |
| Esa | 6 |
| Epta | 7 |
| Otta | 8 |
| Nona | 9 |
| Deca | 10 |
Se la coppia di elementi è presente con un numero di atomi maggiore di 1 si utilizzano i prefissi greci.
Il prefisso 'mono', può essere omesso.
Nel caso il secondo elemento sia l'ossigeno
si deve partire col termine ossido .
Seguendo questi criteri SO2=diossido di zolfo ( non di monozolfo)
mentre va specificato completamente N2O5=pentossido
di diazoto.
La seguente tabella può dare una idea delle varie eventualità.
| Formula | Nome IUPAC | Nome comune |
| FeCl2 | Dicloruro di ferro | Cloruro ferroso |
| FeCl3 | Tricloruro di ferro | Cloruro ferrico |
| CO | Ossido di carbonio | Ossido di carbonio |
| CO2 | Diossido di carbonio | Anidride carbonica |
| P2O3 | Triossido di di fosforo | Anidride fosforosa |
| P2O5 | Pentossido di di fosforo | Anidride fosforica |
| N2O | ossido di di azoto | Protossido di azoto |
| NO | Ossido di azoto | Ossido di azoto |
| N2O3 | Triossido di di azoto | Anidride nitrosa |
| NO2 | Diossido di azoto | Ipoazotide |
| N2O5 | Pentossido di di azoto | Anidride nitrica |
| HCl | Cloruro di idrogeno | Acido cloridrico |
| Hg2Cl2 | Dicloruro di di mercurio | Calomelano |
| H2S | Solfuro di di idrogeno | Acido solfidrico |
| H2O | Ossido di idrogeno | Acqua |
| H2O2 | Perossido di idrogeno | Acqua ossigenata |
| PH3 | Triidruro di fosforo | Fosfina |
| MoO4 | Tetrossido di molibdeno | Tetrossido di molibdeno |
| OF2 | Fluoruro di idrogeno | Fluoruro di idrogeno |
qui sotto la molecola H2O2
Ossidi
Come si vede dalla precedente tabella dei composti binari tutti i composti
in cui appare l'ossigeno vengono denominati ossidi: gli ossidi, sono
composti che tutti gli elementi formano con l'ossigeno.
Gli ossidi, si dividono in ossidi basici, ossidi acidi (anidridi) e
ossidi anfoteri

Ossidi basici : sono composti binari formati dalla combinazione di due soli elementi, l'ossigeno ed un elemento metallico anche in proporzioni diverse tra loro (i metalli sono tutti gli elementi collocati a sinistra della diagonale boro-astato della tavola periodica).
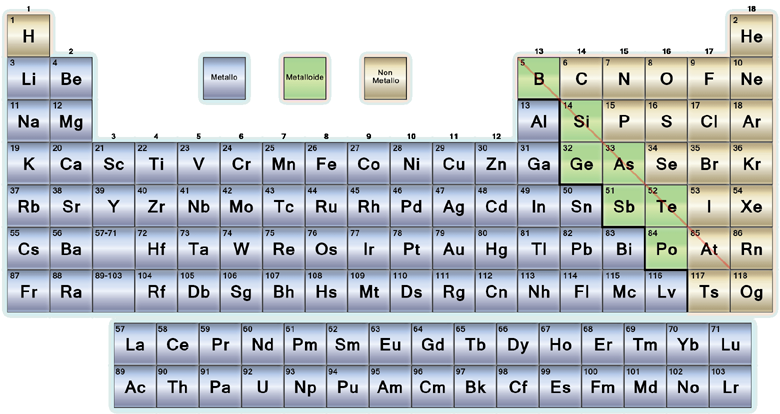
La formula di questi composti si ottiene scrivendo prima il simbolo
del metallo, seguito dal simbolo dell'ossigeno (ad es. FeO) secondo
una regola che prevede che gli elementi siano
scritti in ordine di elettronegatività crescente.
Ciascun elemento presenta in basso a destra l'indice relativo al rapporto
degli atomi costituenti: questo numero coincide col numero di ossidazione
dell'altro elemento.
Come si vede nella tabella, il nome IUPAC viene formato facendo seguire
alla locuzione ossido di con il nome del metallo.
Se il metallo presenta due numeri di ossidazione, nella nomenclatura
chimica tradizionale, si adoperano le desinenze -oso
ed -ico per indicare rispettivamente
, il numero di ossidazione più basso e più alto (ad es.SnO=ossido
stannoso SnO2=ossido stannico). Di seguito alcuni esempi
di ossidi basici.
| Ossidi basici | |||
| n.o. | Formula | Nome IUPAC | Nome comune |
| +1 | Li2O | Ossido di dilitio | Ossido di litio |
| +1 | Na2O | Ossido di disodio | Ossido di sodio |
| +2 | MgO | Ossido di magnesio | Ossido di magnesio |
| +2 | CaO | Ossido di calcio | Ossido di calcio |
| +2 | CrO | Ossido di cromo | Ossido cromoso |
| +3 | Cr2O3 | Triossido di dicromo | Ossido cromico |
| +2 | MnO | Ossido di manganese | Ossido manganoso |
| +3 | Mn2O3 | Triossido di dimanganese | Ossido manganico |
| +2 | SnO | Monossido di stagno | Ossido stannoso |
| +3 | Tl2O3 | Triossido di ditallio | Ossido di tallio |
Ossidi acidi (anidridi) :sono composti binari tra ossigeno e un non metallo oppure un metallo con un elevato numero di ossidazione (5,6,7).
 Nel caso della nomenclatura tradizionale il termine anidride è
ancora correntemente usato, inoltre bisogna fare attenzione ai numeri
di ossidazione; ad esempio nel caso degli alogeni dove vi sono quattro
numeri di ossidazione (+1,+3,+5,+7) i composti che li contengono vengono
denominati usando i prefissi e suffissi
Nel caso della nomenclatura tradizionale il termine anidride è
ancora correntemente usato, inoltre bisogna fare attenzione ai numeri
di ossidazione; ad esempio nel caso degli alogeni dove vi sono quattro
numeri di ossidazione (+1,+3,+5,+7) i composti che li contengono vengono
denominati usando i prefissi e suffissi
ipo- (+1)
-oso (+3)
-ico (+5)
per- (+7) come riportato
nella seguente tabella.
| Ossidi acidi | |||
| n.o. | Formula | Nomenclatura IUPAC | Nome comune |
| +3 | B2O3 | triossido di diboro | Anidride borica |
| +2 | CO | Monossido di carbonio | Ossido di carbonio |
| +4 | CO2 | Diossido di carbonio | Anidride carbonica |
| +1 | N2O | Ossido di diazoto | Protossido di azoto |
| +2 | NO | Monossido di azoto | Ossido di azoto |
| +3 | N2O3 | Triossido di diazoto | Anidride nitrosa |
| +4 | NO2 | Diossido di azoto | Anidride nitroso/nitrica |
| +4 | N2O4 | Tetraossido di diazoto | Ipoazotide |
| +5 | N2O5 | Pentaossido di diazoto | Anidride nitrica |
| +3 | P4O6 | Esaossido di tetrafosforo | Anidride fosforosa |
| +5 | P4O10 | Decaossido di tetrafosforo | Anidride fosforica |
| +4 | SO2 | Diossido di zolfo | Anidride solforosa |
| +6 | SO3 | Triossido di zolfo | Anidride solforica |
| +1 | Cl2O | Ossido di dicloro | Anidride ipoclorosa |
| +3 | Cl2O3 | Triossido di dicloro | Anidride clorosa |
| +5 | Cl2O5 | Pentaossido di dicloro | Anidride clorica |
| +7 | Cl2O7 | Eptaossido di dicloro | Anidride perclorica |
| +6 | CrO3 | Triossido di cromo | Anidride cromica |
| +7 | Mn2O7 | Eptaossido di dimanganese | Anidride permanganica |
qui sotto la molecola N2O3
Ossidi anfoteri :sono
composti binari tra l'ossigeno ed un semimetallo, cioè un elemento
che si trova in prossimità della diagonale boro-astato della
tavola periodica.
Sono composti che hanno la caratteristica di essere solubili sia nelle
soluzioni acide che in quelle basiche.
La nomenclatura degli ossidi anfoteri segue le regole degli ossidi metallici.
Di seguito alcuni esempi di ossidi anfoteri.
| Ossidi anfoteri | |||
| n.o. | Formula | Nome IUPAC | Nome comune |
| +2 | ZnO | Ossido di zinco | Ossido di zinco |
| +4 | SnO2 | Diossido di stagno | Ossido stannico |
| +3 | Al2O3 | Triossido di dialluminio | Allumina |
| +3 | Cr2O3 | Triossido di dicromo | Ossido cromico |
| +3 | Mn2O3 | Triossido di dimanganese | Ossido manganico |
Perossidi :
sono composti binari nei quali l'ossigeno presenta numero di ossidazione
-1.
Ad esempio l'acqua ossigenata H2O2 oppure Na2O2
e BaO2.
Esistono poi dei casi rari come i superossidi dove l'ossigeno presenta
numero di ossidazione -1/2 come KO2 e CsO2.
Idrossidi (idrati) : possono essere ottenuti per reazione con acqua da un ossido basico, purchè questo sia almeno parzialmente solubile:
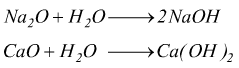
Il nome di questi composti ternari, formati da un metallo, un ossigeno ed un idrogeno si ottiene facendo precedere la parola idrossido al nome del metallo. Il numero di ossidazione di quest'ultimo viene indicato con le desinenze -oso o -ico.
| Idrossidi | ||
| Formula | Nome IUPAC | Nome comune |
| NaOH | Idrossido di sodio | Soda caustica |
| Ca(OH)2 | Diidrossido di calcio | Calce spenta |
| Fe(OH)2 | Diidrossido di ferro | Idrossido ferroso |
| Fe(OH)3 | Triidrossido di ferro | Idrossido ferrico |
La formula dell'idrossido si ottiene scrivendo prima il simbolo dell'elemento
e quindi un numero di idrossili OH pari al numero di ossidazione del
metallo, in base al numero di ossidrili che lo forma, un idrossido è
monovalente, bivalente etc.
Le caratteristiche degli idrossidi solubili in acqua sono le cosidette
proprietà basiche: la lisciviosità al tatto, il sapore
amaro e bruciante, la capacità di colorare in modo netto gli
indicatori.
Acidi
Gli acidi sono una importante classe di composti molecolari. Un acido
è una sostanza che produce ioni idrogeno H+ quando
viene sciolto in acqua.
La caratteristica degli acidi è dunque il possesso di idrogeni
mobili.

Ad esempio il cloruro di idrogeno HCl è un composto gassoso
ma quando viene sciolto in acqua viene chiamato acido cloridrico, lo
stesso accade per il fluoruro di idrogeno HF che sciolto in acqua diventa
acido fluoridrico.
La denominazione degli acidi semplici segue una regola molto semplice:
alla parola idrogeno viene sostituita la parola acido mentre la desinenza
-uro diventa -ico.
Questa regola vale anche per i composti non binari, come ad esempio
HCN=cianuro di idrogeno che sciolto in acqua diventa acido cianidrico.
Idracidi : sono composti
dell'idrogeno con gli alogeni, lo ione cianuro e alcuni elementi del
gruppo dell'ossigeno (calcogeni) .Il loro nome corrente è formato
dalla parola acido seguita dal nome dell'elemento con il postfisso -idrico.
Nella nomenclatura IUPAC si usa il nome dell'anione (desinenza -uro)
seguito da 'di' idrogeno.
Nella tabella seguente alcuni esempi di nomenclatura per gli idracidi.
| Idracidi | ||
| Formula | Nome IUPAC | Nome comune |
| HF | Fluoruro di idrogeno | Acido fluoridrico |
| HCl | Cloruro di idrogeno | Acido cloridrico |
| HBr | Bromuro di idrogeno | Acido bromidrico |
| HI | Ioduro di idrogeno | Acido iodidrico |
| H2S | Solfuro di diidrogeno | Acido solfidrico |
| H2Se | Seleniuro di diidrogeno | Acido selenidrico |
| HCN | Cianuro di idrogeno | Acido cianidrico |
Ossiacidi : si ottengono formalmente, per somma di una o più molecole di acqua alle rispettive anidridi
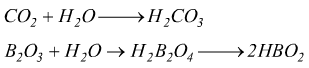
Da quello che si vede in questi esempi si deduce che:
• nello scrivere le formule degli ossiacidi si mette prima l'idrogeno,
poi il non metallo (o il semimetallo) ed infine l'ossigeno.
• quando gli indici della formula di un acido sono divisibili per
una stesso sottomultiplo, la semplificazione va fatta.
Per dedurre in modo semplice i nomi degli ossiacidi conviene riportare in una tabella le categorie in cui possono essere distinti gli elementi:
| 1a categoria Elementi con un solo ossido convertibile in acido | 2a categoria Elementi con due ossidi convertibili in acidi | 3a categoria Elementi con pi? di due ossidi convertibili in acidi |
| Boro B2O3 | Antimonio Sb2O3 e Sb2O5 | Manganese MnO2 MnO3 Mn2O7 |
| Carbonio CO2 | Arsenico As2O3 As2O5 | Bromo Br2O Br2O3 Br2O5 Br2O7 |
| Cromo CrO3 | Azoto N2O3 N2O5 | Cloro Cl2O Cl2O3 Cl2O5 Cl2O7 |
| Silicio SiO2 | Fosforo P2O3 P2O5 | Fluoro F2O F2O3 F2O5 F2O7 |
| Vanadio V2O5 | Zolfo SO2 SO3 | Iodio I2O I2O3 I2O5 I2O7 |
Gli acidi derivanti dalla 1a categoria ricevono nomi terminanti in -ico.
![]() acido carbonico
acido carbonico
![]() acido cromico
acido cromico
Gli acidi derivanti dalla 2a categoria ricevono nomi terminanti rispettivamente in -oso e in -ico.
![]() acido solforoso
acido solforoso
![]() acido solforico
acido solforico
Gli acidi derivanti dalla 3a categoria hanno nomi speciali, prevedono prefissi come per- e ipo- e mantegono i suffissi -oso ed -ico. Ad es. per il manganese:
![]() acido manganoso
acido manganoso
![]() acido manganico
acido manganico
![]() acido
permanganico
acido
permanganico
Per il cloro
![]() acido ipocloroso
acido ipocloroso
![]() acido cloroso
acido cloroso
![]() acido clorico
acido clorico
![]() acido
perclorico
acido
perclorico
In pratica, quando gli acidi liberano i protoni (H+) si
trasformano negli anioni corrispondenti.
La declinazione dell'anione ottenuto deriva da quella dell'acido:
-ato deriva da -ico
-ito deriva da -oso
Il diverso grado di idratazione viene indicato coi prefissi
orto- per l'acido a più alto
grado di idratazione (ad es. P2O5+3H2O=2H3PO4)
piro- per l'acido a idratazione intermedia
(ad es. P2O5+2H2O=H4P2O7)
meta- per l'acido a più basso
grado di idratazione (ad es. P2O5+H2O=2HPO3)
| Ossiacidi | |||||
| n.o. | Anidride | Acido | Nome IUPAC | Nome comune | Anione |
| +3 | B2O3 | H3BO3 | Acido triossoborico | Acido ortoborico | BO33- ortoborato |
| +3 | B2O3 | HBO2 | Acido diossoborico | Acido metaborico | BO2- metaborato |
| +4 | CO2 | H2CO3 | Acido triossocarbonico | Acido carbonico | CO32- carbonato |
| +4 | SiO2 | H4SiO4 | Acido tetraossosilicico | Acido ortosilicico | SiO44- ortosilicato |
| +3 | N2O3 | HNO2 | Acido diossonitrico | Acido nitroso | NO2- nitrito |
| +5 | N2O5 | HNO3 | Acido triossonitrico | Acido nitrico | NO3- nitrato |
| +5 | P2O5 | H3PO4 | Acido tetraossofosforico | Acido ortofosforico | PO43- ortofosfato |
| +5 | P2O5 | H4P2O7 | Acido eptaossodifosforico | Acido pirofosforico | H2P2O72- pirofosfato diacido |
| +5 | P2O5 | HPO3 | Acido triossofosforico | Acido metafosforico | PO3- metafosfato |
| +4 | SO2 | H2SO3 | Acido triossosolforico | Acido solforoso | SO32- solfito |
| +6 | SO3 | H2SO4 | Acido tetraossosolforico | Acido solforico | SO42- solfato |
| +1 | Cl2O | HClO | Acido monossoclorico | Acido ipocloroso | ClO- ipoclorito |
| +3 | Cl2O3 | HClO2 | Acido diossoclorico | Acido cloroso | ClO2- clorito |
| +5 | Cl2O5 | HClO3 | Acido triossoclorico | Acido clorico | ClO3- clorato |
| +7 | Cl2O7 | HClO4 | Acido tetraossoclorico | Acido perclorico | ClO4- perclorato |
Idruri
Gli idruri binari sono combinazioni tra l'idrogeno ed un altro elemento (metallo o non metallo) si hanno
Idruri ionici : quando idrogeno molecolare si combina direttamente con un metallo che in genere è alcalino o alcalinoterroso ad es.
![]()
Idruri covalenti
: quando l'idrogeno si combina con legame covalente con un altro elemento,
ad es. NH3 o H2O.
Qui una mappa rappresentativa di varie possibilità
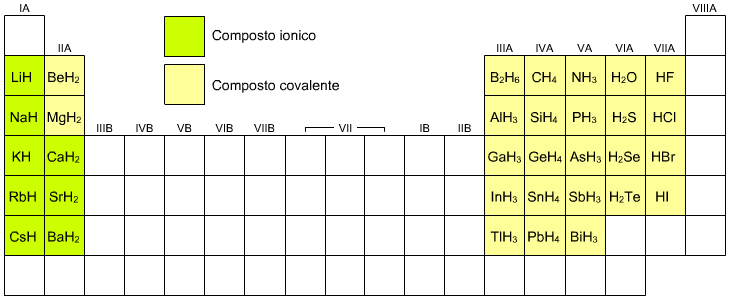
I sali
I Sali: si ottengono per reazione di un acido con una base anche se
formalmente essi possono essere ottenuti sostituendo dei metalli agli
idrogeni degli acidi.
Il nome di un sale si definisce nominando prima la parte non metallica,
con gli stessi prefissi e suffissi già visti nel caso degli acidi
e degli ossidi e poi la parte metallica con suffissi -oso ed -ico a
secondo del numero di ossidazione del metallo.
Sali semplici :
sono prodotti dalla sostituzione di tutti gli atomi di idrogeno acidi
presenti nella molecola.
I loro nomi si ottengono sostituiendo i prefissi tipici dell'acido:
-ico diventa -ato
-oso diventa -ito
-idrico diventa -uro
Qui sotto esempi di nomenclatura di Sali derivati dagli acidi più comuni
| Sali semplici | |||
| Acido | Sale | Nome IUPAC | Nome comune |
| HCl acido cloridrico | CaCl2 | Dicloruro di calcio | Cloruro di calcio |
| HNO2 acido nitroso | Al(NO2)3 | Triossidonitrato di alluminio | Nitrito di alluminio |
| H2SO4 acido solforico | Sn(SO4)2 | Ditetraossosolfato di stagno | Solfato stannico |
| H3PO4 acido fosforico | Sn3(PO4)2 | Ditetraossofosfato di stagno | Ortosolfato stannoso |
| HClO acido ipocloroso | NaClO | Monossoclorato di sodio | Ipoclorito sodico |
| HClO2 acido cloroso | LiClO2 | Diossoclorato di litio | Clorito di litio |
| HClO3 acido clorico | NaClO3 | Triossoclorato di sodio | Clorato di sodio |
| HNO3 acido nitrico | Pb(NO3)2 | Ditriossonitrato di piombo | Nitrato piomboso |
| H2SO3 acido solforoso | Cu2SO3 | Triossosolfato di rame | Solfito rameoso |
| HClO4 acido perclorico | Ba(ClO4)2 | Ditetraossoclorato di bario | Perclorato di bario |
| H2CO3 acido carbonico | Fe2(CO3)3 | Tritriossocarbonato di ferro | Carbonato ferrico |
| H2S acido solfidrico | ZnS | Solfuro di zinco | Solfuro di zinco |
Sali acidi : non
sempre un metallo entrando a formare un sale, sostituisce completamente
gli atomi di idrogeno; i sali acidi si ottengono per parziale sostituzione
degli atomi di idrogeno di un acido.
Di seguito alcuni esempi di Sali acidi
| Sali acidi | ||
| Formula | Nome IUPAC | Nome comune |
| NaHCO3 | Idrogenocarbonato di sodio | Bicarbonato di sodio |
| KHSO3 | Idrogenosolfito di potassio | Bisolfito di potassio |
| KHSO4 | Idrogenosolfato di potassio | Bisolfato di potassio |
| Na2PO3 | Idrogenofosfito di sodio | Fosfito monosodico |
| Na2PO4 | Diidrogenofosfato di sodio | Fosfato diacido di sodio |
| K2HPO4 | Idrogenofosfato di potassio | Fosfato monoacido di potassio |
Sali basici : un sale può essere considerato come derivato da una base per parziale o totale sostituzione degli ossidrili OH,. si comprende allora come si possano avere dei sali basici di cui riportiamo alcuni esempi
| Sali basici | ||
| Formula | Nome IUPAC | Nome comune |
| MgF(OH) | Idrossofluoruro di magnesio | Fluoruro monobasico di magnesio |
| FeCl(OH)2 | Diidrossocloruro di ferro | Cloruro dibasico di ferro |
Ioni
Il numero di protoni (cariche positive) nel nucleo di un atomo rimane uguale durante le normali reazioni chimiche, mentre gli elettroni carichi negativamente possono essere persi o acquistati portando alla formazione di ioni. Uno ione è un atomo o un gruppo di atomi che ha una carica netta positiva o negativa.
Uno ione atomico è costituito da un solo atomo avente carica
positiva o negativa .
La perdita di uno o più elettroni da parte di un atomo produce
un catione: uno ione, ha carica netta positiva (ad es. Na+).

Un anione è uno ione la cui carica netta è negativa a causa di un aumento del numero di elettroni (ad es. Cl-)
| Ioni atomici | |||
| n.o. | Simbolo | Nome IUPAC | Nome Comune |
| -3 | N3- | Nitruro | Ione azoturo |
| -2 | S2- | Solfuro | Ione solfuro |
| -1 | Cl- | Cloruro | Ione cloruro |
| +1 | Na+ | Sodio | Ione sodio |
| +2 | Sn2+ | Stagno (II) | Ione stannoso |
| +2 | Fe2+ | Ferro (II) | Ione ferroso |
| +3 | Fe3+ | Ferro (III) | Ione ferrico |
| +3 | Al3+ | Alluminio | Ione alluminio |
| +4 | Sn4+ | Stagno (IV) | Ione stannico |
Gli anioni monoatomici (Cl- etc..) vengono indicati aggiungendo
al nome il suffisso -uro preceduto dalla parola ione.
I cationi monoatomici si indicano semplicemente aggiongendo la parola
'ione' al nome dell'elemento (K+=ione potassio).
Certi metalli possono formare cationi con umero di cariche differenti
come nel caso del ferro che nei vecchi sistemi di nomenclatura veniva
indicato
Fe2+=ione ferroso
Fe3+=ione ferrico
cioè mettendo la desinenza -oso al catione con carica positiva
inferiore e la desinenza -ico al catione con carica positiva superiore.
Per la nomenclatura moderna è sufficiente indicare ione Fe(II)
e ione Fe(III).
 edutecnica
edutecnica