Cinetica chimica
La cinetica chimica è lo studio della velocità con cui avvengono le reazioni chimiche. Si occupa di capire come e perché le sostanze chimiche si trasformano in altre sostanze e quanto tempo ci vuole per completare questa trasformazione.
In sostanza, la cinetica chimica si concentra sullo studio di come le reazioni chimiche avvengono e su quali fattori influenzano la loro velocità.
Ogni reazione chimica è dotata di una sua cinetica, la trasformazione dei reagenti nei prodotti di una reazione, può infatti avvenire in un unico atto reattivo oppure con una sequenza di reazioni intermedie.
Supponendo di usare due reagenti A e B, per l'attuarsi della reazione è necessario che le molecole di A e B si urtino e che l'urto sia efficace, cioè che la collisione fra le molecole avvenga con un'energia sufficiente per garantire la reazione.
Tutte le molecole hanno la parte più esterna costituita da carica negativa;
quando esse si trovano a distanza dell'ordine di pochi nm tendono a respingersi.
D'altra parte affinché le molecole di A e B reagiscano fra loro è necessario
che avvenga una compenetrazione fra esse o meglio fra le loro atmosfere
elettroniche, andando a costituire per un intervallo di tempo molto breve
un'unica entità instabile chiamata complesso attivato
che poi si rompe dando luogo alle molecole C e D.
![]()
La formazione del complesso attivato avviene a spese dell'energia cinetica delle molecole: la forza repulsiva fra le molecole di A e B deve essere vinta dall'energia cinetica delle molecole stesse.
Se il complesso attivato non si forma la reazione non avviene.
La reazione consiste essenzialmente nel riarrangiamento degli elettroni
degli atomi che costituiscono il complesso attivato in nuove strutture
col minimo contenuto di energia possibile: i prodotti della reazione.
La velocità di una reazione oltre a dipendere dal tipo di reazione e dalla
natura chimica dei reagenti, dipende anche dalla temperatura.
Si definisce energia di attivazione Ea,
l'energia necessaria affinché avvenga la reazione; come descritto nell'
l'equazione di Arrhenius:
![]()
dove
k= costante, chiamata di velocità specifica
di reazione.
A=fattore di frequenza :costante che dipende dalla natura dei reagenti
e=2,718 base di logaritmi naturali
Ea=energia di attivazione della reazione
R=8,314 J/mol°K=costante universale dei gas
T=temperatura assoluta in °K
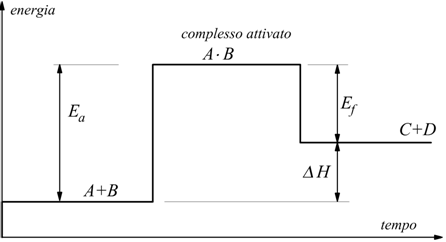
Ea= energia di attivazione delle molecole di A e B per formare
il complesso attivato.
Ef= energia liberata nella formazione di C e D dal complesso
attivato.
Osservando la figura si può dire che fra i prodotti iniziali e finali
di una reazione esiste una barriera di energia (non considerata dalla
termodinamica che si interessa solo della variazione d entalpia ΔH)
che ha una certa importanza nella pratica, perché è l'ostacolo che va
superato affinché la reazione abbia luogo.
Generalmente questo ostacolo viene superato fornendo calore ai reagenti
A e B, aumentando la loro temperatura e quindi l'energia media delle loro
molecole.
Un catalizzatore può fornire alla reazione chimica un percorso alternativo,
aumentandone la velocità senza essere modificato dalla reazione. L'aumento
della velocità viene reso possibile grazie alla diminuzione dell'energia
di attivazione.
Velocità di reazione
Lo studio cinetico di una reazione prevede il rilevamento sperimentale
della velocità con cui si svolge la stessa.
Si calcola la velocità di come una sostanza A, reagisce esprimendola come
la diminuzione del numero di moli di A nell'unità di tempo. Indicando
con |A| la concentrazione molare della specie A:
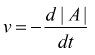
La conoscenza dei valori numerici delle velocità di reazione si ottiene soltanto per via sperimentale.
Ordine di reazione
Si definisce ordine di reazione il numero che esprime la somma degli esponenti con cui le concentrazioni delle singole specie chimiche compaiono nell'espressione della velocità di reazione.
Generalizzando, la reazione
![]()
la cui velocità può essere espressa come
![]()
è di ordine α+β
Notare che gli esponenti con cui le concentrazioni e le specie A e B compaiono nelle equazioni della velocità sono diversi dai coefficienti che compaiono nella reazione in cui sono coinvolti, quindi, l'ordine di una reazione non può essere ricavato in base all'equazione stechiometrica che descrive la reazione, ma deve essere ottenuto effettuando misure di velocità di reazione.
Notiamo che se nell'equazione precedente si ha |A|=|B|=1 risulta v=k quindi k rappresenta la velocità di reazione nel caso che le specie reagenti siano a concentrazione unitaria (1M) per questo k viene chiamata velocità specifica di reazione.
Reazioni di primo ordine
Nelle reazioni del primo ordine la velocità di reazione dipende solo da un reagente:
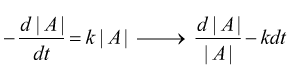
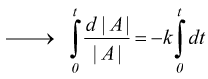
quindi
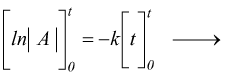
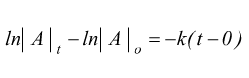 si
ha
si
ha
![]()
dove |A|o e |A|t sono la concentrazione molare iniziale del componente A e quella che si ha dopo un determinato tempo t dall'inizio della reazione. .
Reazioni di secondo ordine
Nelle reazioni del secondo ordine la velocità di reazione dipende dal quadrato della concentrazione di un singolo reagente.
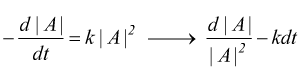
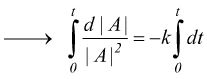 quindi
quindi
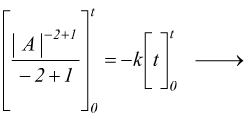
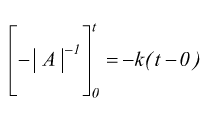 si
ha
si
ha
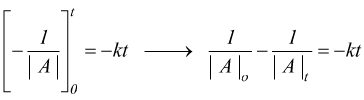 cioè
cioè
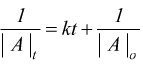
oppure la velocità è proporzionale al prodotto delle concentrazioni di due reagenti
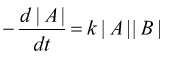 che
integrata dà:
che
integrata dà: 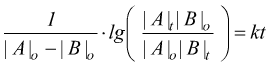
dove |A|o , |A|t , |B|o e |B|t sono le concentrazioni dei reagenti nell'istante iniziale e al tempo generico t.
La tabella seguente riassume i parametri che possono essere ricavati per le equazioni cinetiche di diverso ordine.
| Reazione | Ordine zero | Primo ordine | Secondo ordine |
| Legge cinetica |
|
|
|
| Unità di misura di k |
|
|
|
| Legge cinetica integrata |
|
|
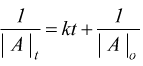 |
| Tempo di dimezzamento |
|
|
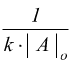 |
 edutecnica
edutecnica