Vapor d'acqua
Nel caso dello studio dei gas si fa sempre riferimento alla definizione di gas perfetto; in realtà, abbiamo visto che i gas reali hanno comportamento diverso perché, se compressi isotermicamente al di sotto della temperatura critica diventano liquidi. Nel caso dell'acqua, gli stati di aggregazione possono essere descritti dal suo diagramma PV .
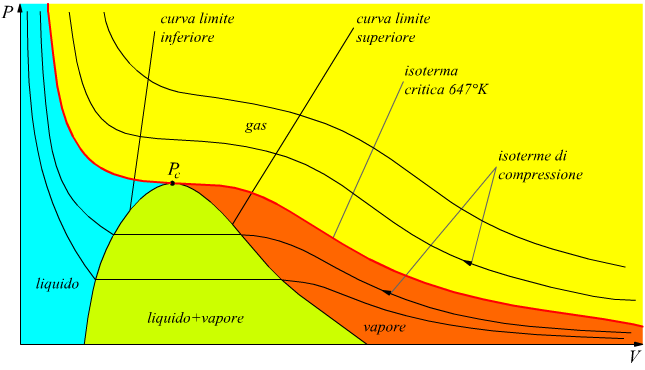
In esso,sono evidenti la zona della fase liquida, della fase liquido+vapore e la zona del vapore surriscaldato.
La caratteristica curva "a campana" della fase liquido+vapore è delimitata a sinistra del punto critico Pc dalla curva limite inferiore e a destra dalla curva limite superiore. Bisogna notare come sotto la campana (nel campo liquido+vapore) le isoterme coincidono con le isobare.
Per l'acqua, il punto critico Pc ha i seguenti valori dei
parametri di pressione,volume specifico e temperatura:
- pressione critica pc=221 bar
- temperatura critica Tc=374°C = 647 °K
- volume critico vc= 0,00317 m3/kg
Dal disegno si vede che se si somministra calore a pressione costante
maggiore del valore di pressione del punto critico, si ottiene l'evaporazione
senza il passaggio attraverso la fase intermedia liquido+ vapore.
In pratica, operando a pressione atmosferica (c.ca 1 bar) il passaggio
liquido vapore avviene attraversando la fase intermedia liquido+vapore.
Ipotizzando, per semplicità, di far evaporare dell'acqua liquida a pressione atmosferica, avremo che la quantità di calore assorbita dal sistema in fase liquida vale
![]() [ kJ ]
[ kJ ]
m=massa del corpo [ kg ]
c=calore specifico [ kJ/kg°K ]
Tf=temperatura finale [ °K ]
Ti=temperatura iniziale [ °K ]
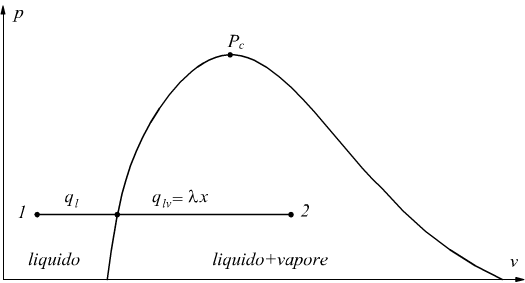
Se l'acqua viene portata all'ebollizione Tf=Te. graficamente la trasformazione corrisponde al tratto 1-2 disegnato in figura.
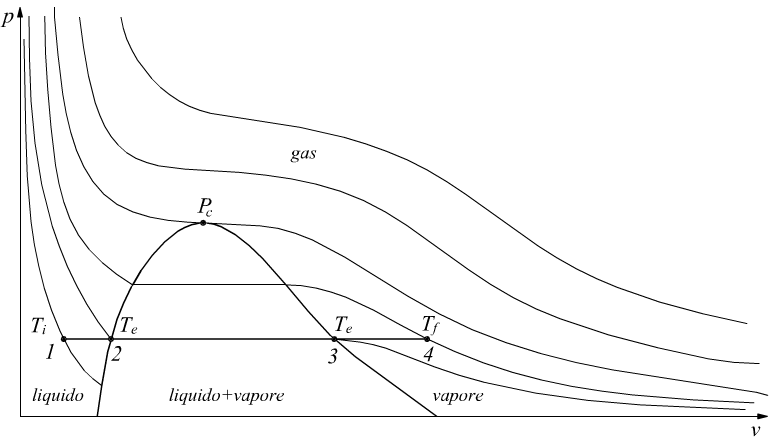
Operando a pressione costante c=cp=4,186 kJ/kg , per m=1kg di acqua
![]() [ kJ/kg ]
[ kJ/kg ]
questo è il calore di riscaldamento in fase liquida.
Qui, bisogna aprire una parentesi e specificare che a pressione costante la quantità di calore assorbita o ceduta in fase liquida coincide con la variazione di entalpia che avevamo definito come
![]()
con U energia interna e PV (pressione×volume) il lavoro scambiato.
Finché l'acqua è in fase liquida non può espandersi, quindi PV=0, inoltre
come
avevamo visto, per convenzione per T=273°K=0° si ha U=0 quindi anche
H=0 a quella temperatura. Ne consegue che se vogliamo sapere il valore
assoluto di entalpia di una determinata massa m di acqua, in fase liquida,
ad una data temperatura 0°C<T<100°C basterà applicare la relazione
:
![]()
Il calore somministrato nel tratto 2-3 si chiama calore latente di vaporizzazione λ se ci riferiamo ad 1kg di acqua la sua dimensione sarà [kJ/kg].
![]()
Bisogna tener conto che λ dipende dalla pressione λ=λ(p) e i suoi valori sono tabellati.
Il vapore nella fase intermedia liquido+vapore viene chiamato vapore umido mentre il vapore ottenuto a temperatura di ebollizione sulla curva limite superiore viene chiamato vapore saturo secco (punto 3).
Se si continua a fornire calore al sistema a pressione costante, si ha la fase 3-4 in cui si ottiene il vapore surriscaldato (punto 4).
Durante questa fase la temperatura aumenta rispetto a quella di ebollizione Te (Te=T2=T3) fino a raggiungere il valore di temperatura Tf (punto 4) chiamata temperatura del vapore surriscaldato.
La quantità di calore fornita nella trasformazione 3-4 è chiamata calore di surriscaldamento.
![]() [ kJ/kg ]
[ kJ/kg ]
dove cpm è il calore specifico medio del vapore surriscaldato che si può fissare a
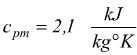
In totale per portare 1kg di acqua dallo stato liquido a quello di vapore surriscaldato:
![]()
poi chiaramente, per una generica massa m di acqua:
![]()
Titolo del vapore
Per individuare qualsiasi stato fisico, quando siamo in fase liquido+vapore, si ricorre al numero adimensionale x chiamato titolo del vapore.
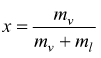
mv=massa di vapor saturo secco
ml=massa del liquido
Il titolo del vapore viene, dunque, definito come il rapporto tra la massa del vapor saturo secco e la massa totale del miscuglio liquido+vapore. La curva limite superiore ha titolo x=1 , la curva limite inferiore ha titolo x=0.
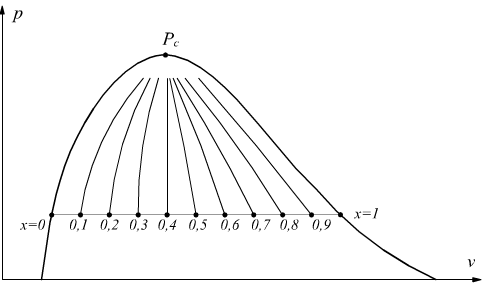
Le curve limite superiore ed inferiore sono curve a titolo costante cioè isotitole. Tra la curva limite superiore e la curva limite inferiore possono essere tracciate molteplici linee isotitole di valore compreso tra 0 ed 1, tutte uscenti dal punto critico Pc.
Se vaporizziamo 1kg di acqua partendo dallo stato liquido 1 per portarlo allo stato 2 di vapore umido con titolo x si spenderà una quantità di calore specifico:
![]()
Consideriamo ora, una determinata massa m di acqua che si trova nella
condizioni di vapore umido (quindi liquido+vapore) ad una determinta
pressione e supponiamo anche di conoscere il volume complessivo V della
miscela di massa m. Per la definizione di volume specifico e indicando
con
vl=volume specifico del liquido saturo
vv=volume specifico del vapore saturo
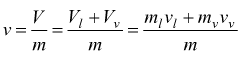 con
con ![]()
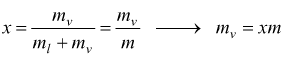 poi
vedendo che è
poi
vedendo che è
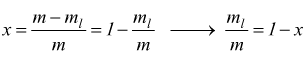 cioè
cioè
![]() avremo
avremo
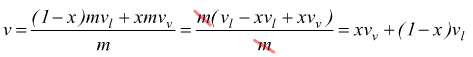 volendo
esplicitare il titolo
volendo
esplicitare il titolo
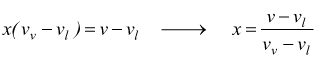
Quindi conoscendo il volume specifico e la massa di una miscela liquido+vapore ad una determinata pressione e utilizzando i volumi specifici del liquido saturo e del vapore saturo per quella pressione è possibile determinare il titolo x della miscela.
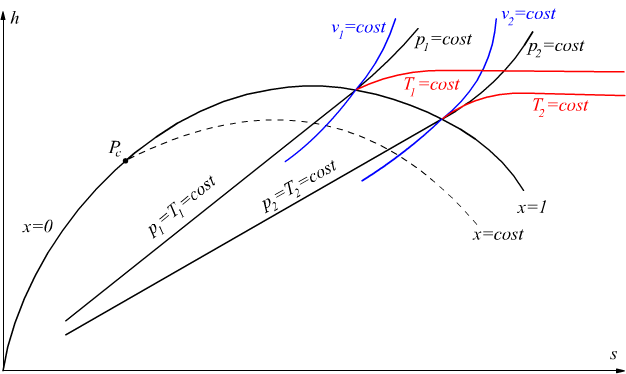
Il diagramma del vapor d'acqua può essere rappresentato anche col sistema di coordinate T-S cioè attraverso il diagramma entropico.
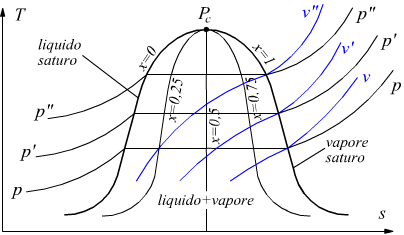 In questo
diagramma si possono ancora riconoscere le tre zone caratteristiche:
liquido, liquido+vapore, vapore surriscaldato.
In questo
diagramma si possono ancora riconoscere le tre zone caratteristiche:
liquido, liquido+vapore, vapore surriscaldato.
Le linee verticali corrispondono alle adiabatiche isoentropiche, mentre
le linee orizzontali sono le isoterme.
Le isobare sono delle curve ascendenti nel campo del liquido e del vapore
surriscaldato mentre coincidono con le isoterme sotto la curva del vapore.
Le isocore sono curve ascendenti con pendenza più accentuata delle isobare.
Diagramma di Mollier
Nelle trasformazioni dove è coinvolto vapor d'acqua, un diagramma molto usato in ambito tecnico è il diagramma di Mollier h-s (entalpia specifica - entropia specifica).
Convenzionalmente per il vapor d'acqua, si assume h=0 ed s=0 a pressione assoluta nulla e a temperatura T=0°C. Gli assi h-s del diagramma hanno origine nel punto che ha le coordinate termodinamiche suddette.
Le trasformazioni isobare sono rappresentate da rette che partono dall'origine
e raggiungono la curva limite superiore, poi diventano curve ascendenti.
Le isoterme sono delle rette coincidenti con le rette delle isobare
sotto la curva del vapore; poi oltrepassato la curva limite superiore
diventano rette parallele all'asse dell'entropia s.
Le isotitole sono curve con origine nel punto critico ed interne alla
curva del vapore.
Qui è riportata una versione più dettagliata del diagramma.
Esempio 1 :
calcolare il valore dell'entalpia specifica del vapore surriscaldato
a temperatura T=300°C alla pressione assoluta p=5bar.
In questo caso dobbiamo individuare l'isobara a 5 bar per poi verificarne
il punto di intersezione con la isoterma a 300°C ottenendo il valore
di h=≅3060 kJ/kg.
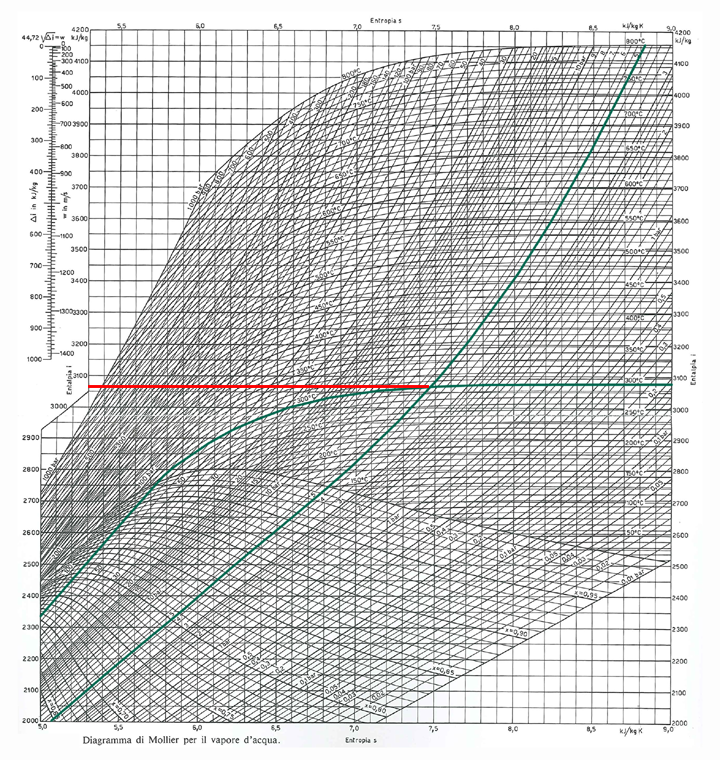
Il punto individuato si trova chiaramente nella zona del vapore surriscaldato.
Esempio 2 :
calcolare l'entalpia specifica del vapore saturo umido alla pressione
assoluta di 5 bar con titolo x=0,85.
Anche in questo caso si intersecano due curve, quella della isobara
a 5 bar e quella del titolo x=0,85.
Si trova un valore di entalpia specifica h≅2440 kJ/kg.
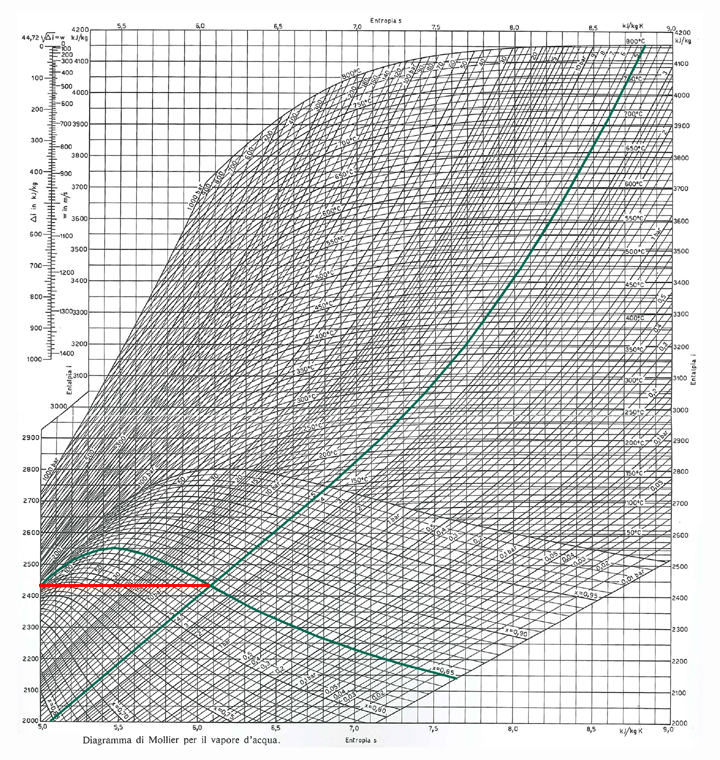
Si nota come il punto individuato si trova nella zona del vapore umido.
 edutecnica
edutecnica