Formule di struttura
Le formule di struttura sono delle rappresentazioni grafiche che prospettano
la formale disposizione delle valenze nei composti.
Mentre le formule molecolari, dette brute o grezze indicano solo il numero
e la qualità degli atomi che costituiscono le molecole, le formule di
struttura aiutano a comprendere quanti elettroni entrano in gioco, a livello
dello strato più esterno degli atomi combinati, nella formazione del composto
rappresentato.
Gli elettroni coinvolti nei legami chimici sono quelli dislocati nel livello energetico più esterno (elettroni di valenza). E' possibile rappresentarli attraverso un metodo secondo nel quale, questi elettroni ( del livello più esterno ) sono rappresentati come punti disposti intorno al simbolo chimico dell'elemento.

La struttura della molecola viene rappresentata basandosi principalmente
sulla regola dell'ottetto.
L'idrogeno, ha un unico livello elettronico esterno costituito da un
doppietto ( 2 elettroni ). Per tutti gli altri elementi il guscio elettronico
più esterno è disponibile sotto forma di 8 orbitali che possono essere
totalmente o parzialmente occupati da un numero rispettivo di elettroni
( elettroni di valenza ).
Gli 8 orbitali sono completamente occupati dagli elettroni solo nel caso
dei gas nobili; questa configurazione risulta, dunque, particolarmente
stabile e caratterizza la scarsa reattività chimica di questi gas .
Per la regola dell'ottetto, un elemento perde, acquisisce oppure condivide elettroni al fine di raggiungere la configurazione stabile del gas nobile che è seguente o precedente a quel dato elemento nella tavola periodica.
Per disegnare la formula di struttura di una molecola bisogna:
I ] Calcolare
gli elettroni di valenza di tutta la molecola.
II ] Si sceglie l'atomo centrale che di solito è l'atomo singolo nella
formula, oppure è il meno elettronegativo, oppure è quello con la valenza
più alta; poi si collegano gli atomi con un trattino che rappresenta due
elettroni ( doppietto ). Gli idrogeni sono
sempre periferici.
III ] Dal numero totale degli elettroni di valenza vengono sottratti quelli
impegnati nei legami; gli elettroni rimanenti ( non di legame ) sono ridistribuiti
al fine di far raggiungere l'ottetto a ciascuno degli atomi coinvolti.
se gli elettroni non sono sufficienti si introducono legami doppi o tripli.
Nella grafica, dunque, ciascun punto corrisponde ad un elettrone, ciascuna linea un doppietto ( 2 elettroni ).
Rispetto alla regola dell'ottetto rimangono delle eccezioni:
— l'atomo centrale può arrivare ad impegnare 10, 12 o 14 coppie
elettroniche ( ottetto espanso )
— l'atomo centrale non completa l'ottetto ma impegna solamente 2,4
o 5 coppie elettroniche ( ottetto incompleto ) .
Si può, in seguito, valutare la stabilità della molecola calcolando la carica formale per ciascun atomo:
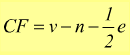
v=valenza
dell'atomo
n=numero di elettroni delle coppie solitarie
e=numero di elettroni impegnati nei legami
La carica formale è una carica attribuibile ad ogni atomo di una struttura, ottenibile confrontando il numero di elettroni dell'atomo neutro ( uguali al numero del gruppo) con gli elettroni assegnabili all' atomo nella struttura che sono tutti gli elettroni dei suoi doppietti solitari ( liberi) e la metà di quelli di legame. La carica formale deve essere il più possibile vicina allo zero. Eventuali cariche formali negative devono stare sull'atomo più elettronegativo.
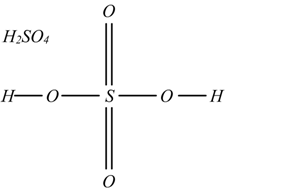
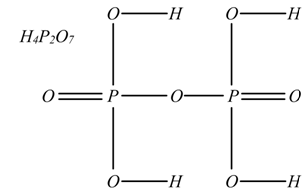
In generale la formula di struttura degli acidi si fa unendo al loro non metallo o al loro semimetallo, tanti ossidrili OH quanti sono gli idrogeni presenti e legando pure allo stesso elemento gli ossigeni restanti.
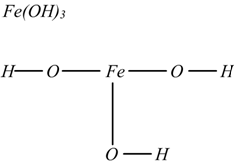
La formula di struttura delle basi si fa unendo al metallo gli ossidrili
La formula di struttura dei sali si fa in modo analogo a quella degli acidi, sostituendo agli idrogeni i metalli, ad esempio:
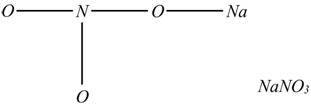
Dovendo avere a che fare con valori di elettronegatività e valenze è meglio procurarsi una tavola periodica.
Facciamo un esempio:
che preveda anche la rappresentazione degli elettroni non condivisi.
Disegnare la struttura dell' SiCl4.
I ] elettroni totali=32

II] L'atomo di silicio è singolo ed è il meno elettronegativo, quindi va
al centro
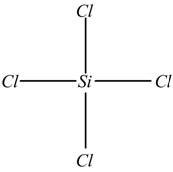
III] con questa soluzione si impegnano 2×4=8 elettroni
ne rimangono 24 da sistemare sui 4 atomi esterni:
24/4=6 elettroni
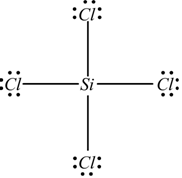
ciascun atomo ha raggiunto l'ottetto
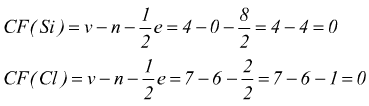
 edutecnica
edutecnica