Molecola
Secondo il modello atomico di Dalton, un elemento è una sostanza pura costituita da un solo tipo di atomi. Un composto è invece una sostanza costituita da due o più atomi differenti. Consideriamo l'acqua che è un composto. Per molecola dell'acqua si intende un raggruppamento di due atomi di idrogeno e uno di ossigeno.
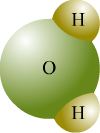
La molecola è la più piccola particella di un composto che possiede le proprietà chimiche di quel composto.
Ogni molecola dell'acqua possiede tutte le proprietà chimiche dell'acqua, e anche quelle fisiche: bolle a 100°C e gela a 0°C.
La molecola è la forma stabile della materia. Può essere formata da atomi uguali o diversi.
La molecola si rappresenta graficamente con la formula che indica da quanti atomi e da che tipo di atomi è formata.
O2:è la formula dell'ossigeno e dice che la molecola dell'ossigeno è formata da due atomi di O.
H2O:è la formula dell'acqua e dice che la formula dell'acqua è formata da due atomi di idrogeno e da uno di ossigeno.
Queste sono le formule grezze, dato che si limitano ad indicarci la qualità e il numero degli atomi che le formano.
Le formule di struttura rappresentano, invece, la struttura, cioè, la posizione degli atomi nella molecola.
![]() formula
di struttura di O2
formula
di struttura di O2
![]() formula
di struttura di H2O
formula
di struttura di H2O
Qualsiasi tipo di materia è formato da molecole.
Peso molecolare
Essendo la molecola formata da più atomi, la massa molecolare è dato dalla somma delle masse degli atomi che la compongono. Noi useremo, comunque, l'espressione peso molecolare PM, anche se è impropria perché le quantità in esame sono delle masse (non delle forze).
In molte versioni della tabella periodica oltre alla sigla dell'elemento e del numero atomico appare il valore del peso atomico (massa atomica) dello stesso, espresso in unità di massa atomica [ u ].
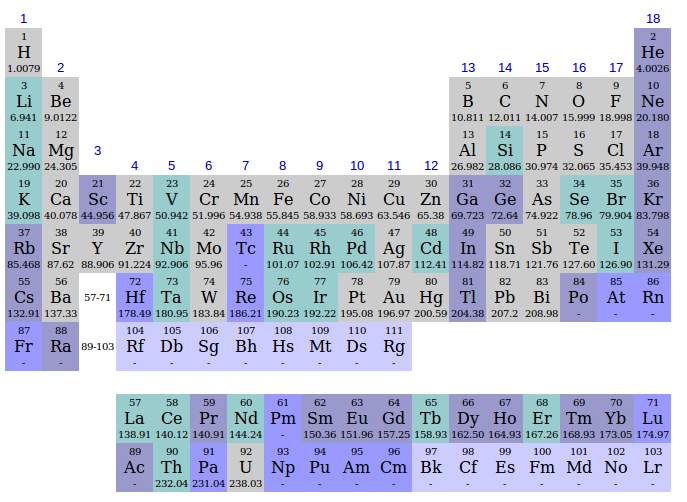
Diventa, in questo modo, molto semplice calcolare il peso molecolare di un composto chimico tenendo conto del fatto che il peso molecolare è espresso in [g/mol].
Esempio 1 : Calcola il peso molecolare dell'acido solforico H2SO4.
2H=2×1,008 =2,016
1S=1×32,064=32,064
4O=4×15,9994=63,998
PM=2,016+32,064+63,998=98,078 g/mol
Esempio 2 : Calcola il peso molecolare del cloroiridiato di potassio K2IrCl6.
2K=2×39,1 =78,2
1Ir=1×192,2=192,2
6Cl=6×35,45=212,7
PM=78,2+192,2+212,7=483,1 g/mol
La mole
La massa di un atomo o di una molecola è sempre molto piccola mentre durante le reazioni chimiche sono coinvolte sempre un numero di particelle molto grande. Per indicare un numero molto elevato e noto di atomi è stata introdotta una speciale unità di misura. Si tratta della mole (simbolo mol) definita nel modo seguente.
Una mole è la quantità di sostanza che contiene 6,02·1023 particelle elementari, cioè atomi, molecole o ioni.
Formalmente, la mole, è per il Sistema Internazionale (SI) l'unità di misura della quantità di materia, anche se in questo sistema la definizione di mole è la seguente:
La mole è la quantità di sostanza contenente tante particelle elmentari quante se ne trovano in 12 g di carbonio-12, simbolo 126C.
La relazione che lega la massa in grammi di una sostanza al numero di moli è la seguente:
![]() 1
1
n=numero di moli
m=massa in grammi [ g ]
PM=peso molecolare [g/mol]
Il numero 6,02·1023 è anche chiamato costante di Avogadro e ha simbolo N.
N=6,02·1023 particelle/mol
dal punto di vista dimensionale l'unità di misura della costante è mol-1.
L'importanza della costante di Avogadro sta nel fatto che essa permette
il passaggio dal livello microscopico (atomo o molecola) a quello macroscopico
(peso molecolare). In caso di necessità, possiamo far riferimento alla seguente
formula :
![]() 2
2
p = numero di particelle (atomi, molecole, ioni, etc...)
n = numero di moli
N = costante di Avogadro
Ad esempio un atomo di ferro Fe ha massa 9,2774·10-23
g.
9,2774·10-23 ·6,02·1023 =55,85
g/mol
e dalla tabella periodica si vede che 55,85g/mol è il peso atomico del ferro.
in questo caso, il numero di partcelle p=1, poi dalla 1
otteniamo ![]() mentre
dalla 2 si ha
mentre
dalla 2 si ha ![]() sostituendo si ha
sostituendo si ha
![]() se
p=1 si trova la relazione precedente: m·N=PM
se
p=1 si trova la relazione precedente: m·N=PM
Se volessimo applicare la stessa regola ad un composto arriveremmo semplicemente a definire il peso molecolare del composto stesso
Una molecola di acqua H2O ha massa 2,993·10-23
g
2,993·10-23· 6,02·1023 =18,02
g/mol
Dato che la massa di una molecola di acqua è proprio 18,02 u cioè u≡g/mol si deduce il peso molare in grammi (di una mole) di un elemento coincide col peso molecolare di quell'elemento.
Esempio 3 : Quanti grammi di H2S ci sono in 0,4 moli di H2S ?
2,016+32,064= 34,08 g/mol
0,4mol × 34,08 g/mol=13,632g
Esempio 4 : Quanti grammi di H e di S sono contenuti in 0,4 moli di H2S ?
Vi sono
2 x 0,4=0,8 u di H
1 x 0,4=0,4 u di S
H =0,8 × 1,008=0,806 g
S =0,4 × 32,064=12,82 g
Reazioni chimiche
E' la combinazione di due o più elementi per formare un composto; è rappresentata da una equazione chimica.
![]()
Indica la reazione fra A e B per formare AB. Al posto del segno '=' puà esserci una freccia '→ '.
![]()
L'equazione è formata da due membri, quello di sinistra, rappresentativo
dei reagenti e quello di destra, rappresentativo
dei prodotti della reazione.
Se esiste una seconda freccia ' ←' la reazione è considerata reversibile.
E' possibile, dunque, partire da degli elementi per ottenere un composto
(sintesi) ma anche partire da un composto per ottenere degli elementi (analisi).
I coefficienti delle sostanze che partecipano ad una reazione indicano
secondo quale numero di moli i vari reagenti partecipano alla reazione.
Pertanto, note le moli di un reagente, si possono dedurre le moli di qualunque
altro reagente che interviene nella stessa reazione e risalire al peso di
questo tramite la formula: ![]() .
.
Esempio 5 : Si devono neutralizzare 600g di HCl con Ca(OH)2 , secondo la reazione:
Ca(OH)2+2HCl → CaCl2+2H2O
Determina quanti grammi di idrossido di calcio sono necessari.
PM(HCl)=36,5
600 g di HCl corrispondono a ![]() moli
di HCl
moli
di HCl
dai coefficienti della reazione si vede che per neutralizzare 2 moli di
HCl ci vuole una mole di Ca(OH)2 , pertanto per neutralizzare
16,5 moli di HCl ci vogliono 8,25 moli di Ca(OH)2.
PM[Ca(OH)2]=74 per cui 8,25 × 74=612 g di Ca(OH)2.
Esempio 6 : Calcola quanti grammi di MnO2 e di HCl sono necessari per preparare 312,4 g di cloro determinare anche quanti grammi di MgCl2 e di H2O si ottengono dalla reazione:
MnO2+4HCl → MnCl2+Cl2+2H2O
PM(CL2)=71
![]() moli;
quindi per effettuare la preparazione occorrono:
moli;
quindi per effettuare la preparazione occorrono:
1 × 4,4=4,4 moli di MnO2
4 × 4,4=17,6 moli di HCl
In conseguenza di questo fatto, si ottengono
1 × 4,4=4,4 moli di MnCl2
2 × 4,4=8,8 moli di H2O
La risposta al problema è dunque
4,4 × PM(MnO2)= 4,4 x 86,94=382 g di MnO2 necessari
17,6 × PM(HCl)= 17,6 x 36,5=641 g di HCl necessari
4,4 × PM(MnCl2)= 4,4 x 125,85=663 g di MnCl2
ottenuti
8,8 × PM(H2O)= 8,8 x 18=158 g di H2O ottenuti
 edutecnica
edutecnica